《表2 ADR报警及判定规则》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《9540例帕瑞昔布相关药品不良反应的自动监测研究》
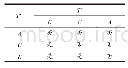
采用真实世界研究方法,利用ADE-ASAS回顾性自动监测2018年1月1日–12月31日期间我院使用帕瑞昔布注射液(40 mg/支,辉瑞制药有限公司,国药准字J20080045)的所有住院患者。参照国家药品不良反应监测中心的《药品不良反应术语使用指南》(征求意见稿),设置“血小板”、“血红蛋白”、“肝功能”及“肾功能”四个模块的报警规则,详见表2。由两名临床药师分别对ADE-ASAS筛查出的报警病例进行人工评价,最终确定阳性病例,分析系统各个模块的阳性报警率及ADR发生率。
| 图表编号 | XD00177527900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.25 |
| 作者 | 黄翠丽、赵轩、郭代红、姚翀、朱曼 |
| 绘制单位 | 解放军总医院医疗保障中心、解放军总医院医疗保障中心、重庆医科大学药学院、解放军总医院医疗保障中心、解放军总医院医疗保障中心、解放军总医院医疗保障中心 |
| 更多格式 | 高清、无水印(增值服务) |



![表1 安全判定规则[4]](http://bookimg.mtoou.info/tubiao/gif/SDHG202008043_01800.gif)
