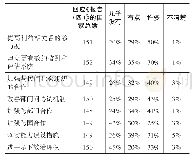
《表1 各国关于脏器质量称量的指南和要求》
不同国家的管理规范指导原则中关于脏器质量推荐操作存在一些差异,缺乏统一的标准。美国食品药品管理局(FAD)的食品安全及应用营养中心(CFSAN)红皮书[8]、美国STP推荐的脏器质量意见书[3]、国际经济合作与发展组织(OECD)指导原则[9]、日本厚生劳动省(MHLW)指南[2]中关于不同的啮齿类和非啮齿类毒性研究需要特定称量的脏器在表1中列出。CFSAN红皮书提出的脏器质量包括12种脏器,即脑、心脏、肝脏、脾脏、肾脏、肾上腺、胸腺、甲状腺、睾丸、附睾、卵巢、子宫。MHLW指南中关于脏器质量的要求与CFSAN类似,不同的是要求必须称量的有前列腺,而子宫、胸腺、甲状腺不是必须称质量。此外,MHLW指南建议肺脏、唾液腺、胸腺、甲状腺、子宫、精囊也是常规的称量脏器。美国STP推荐的常规称量脏器包括肝脏、心脏、肾脏、脑、睾丸(最好的是性成熟动物)以及肾上腺。除小鼠外的其他种属都需要称量甲状腺和垂体。啮齿类动物还需要称量脾脏和胸腺[3]。中国国家药品监督管理局药品审评中心(CDE)在药物重复给药毒性试验技术指导原则[10]中关于脏器质量的要求与美国CFSAN、欧洲OECD的指导原则基本保持一致。尽管各国关于生殖器官(如附睾、精囊腺、前列腺等)、内分泌器官(垂体、甲状腺)脏器称量的要求仍存在细微差别,但重要脏器都是需要称量。因此根据化合物的不同,并结合相应的指导原则,选择合适的脏器进行称量对于科学准确地评估药物毒性作用至关重要。
| 图表编号 | XD00177501000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.08 |
| 作者 | 张頔、姜华、杨艳伟、霍桂桃、屈哲、吕建军、林志 |
| 绘制单位 | 中国食品药品检定研究院国家药物安全评价监测中心、中国食品药品检定研究院国家药物安全评价监测中心、中国食品药品检定研究院国家药物安全评价监测中心、中国食品药品检定研究院国家药物安全评价监测中心、中国食品药品检定研究院国家药物安全评价监测中心、中国食品药品检定研究院国家药物安全评价监测中心、中国食品药品检定研究院国家药物安全评价监测中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式




![表1 各国和国际组织关于电磁暴露限值的规定汇总表[9,19]](http://bookimg.mtoou.info/tubiao/gif/ZGYL202006015_03400.gif)