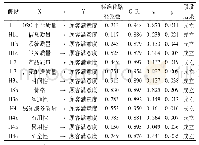
《表1 达芦那韦主要研究汇总表格》
Symtuza是DRV/c/FTC/TAF的四合一制剂,于2018年7月17日被FDA获批上市。AMBER[12]研究是Ⅲ期、多中心、随机对照研究,评估DRV/c/FTC/TAF对比DRV/c和FTC/TDF在HIV-1初治病人中的疗效和安全性,48周病毒学应答率DRV/c/FTC/TAF显著优于DRV/c和FTC/TDF(91.4%vs.88.4%,P<0.000 1)。未发现DRV等蛋白酶、TDF/TAF相关耐药,DRV/c/FTC/TAF组有1例出现M184V/I和K103N突变。EMERALD[13]研究纳入既往无DRV基因突变及病毒学失败史的经治病人,随机分为DRV/c/FTC/TAF组和继续原增强剂增强的(boosted)PI+FTC/TDF方案组,结果显示48周病毒学失败率STR组非劣效于原方案组(2.5%vs.2.1%),3~4级不良反应比例均≤2%,血脂以及肾功能参数维持稳定。其中一名患者有L103A突变,这与先前使用依非韦伦、恩曲他滨和富马酸替诺福韦二丙酯有关。Flamingo试验[14-15]是一项3b期、随机(1∶1)、开放标签、非劣效性(边缘―12%)试验。比较了初治受试者使用DTG(50 mg)和DRV/r(800/100 mg),每天一次第48周使用FDA快照算法(缺失、转换或中断等失败)检测HIV RNA<50拷贝/m L的参与者比例。在初步分析中,DTG组217/242(90%)和DRV/r组200/242(83%)的病人在第48周的HIV-RNA<50拷贝/m L:差异7.1%(95%可信区间:0.9~13.2)。未观察到因治疗引起的原发性整合酶、蛋白酶或核苷类耐药突变。相关研究情况见表1。
| 图表编号 | XD00174457300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.26 |
| 作者 | 姜太一、粟斌、汪雯、吴昊、张彤 |
| 绘制单位 | 首都医科大学附属北京佑安医院感染中心、首都医科大学附属北京佑安医院感染中心、首都医科大学附属北京佑安医院感染中心、首都医科大学附属北京佑安医院感染中心、首都医科大学附属北京佑安医院感染中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式