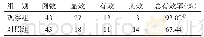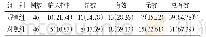《表2 阿尔茨海默病下γ节律的研究总结》
在大量的啮齿类动物研究中也发现了AD模型鼠的γ节律受到损伤(表2).目前常见的啮齿类动物AD模型主要有转基因模型和非转基因模型:转基因模型中突变基因主要有APP、PS1、PS2、APOE基因以及tau蛋白、P301L基因等;非转基因模型是向脑内注射Aβ片段诱导Aβ沉积或注射蛋白磷酸酶抑制剂等诱导tau蛋白过度磷酸化.研究发现,在运动态下3×Tg(PS1、APP、tauP301L)小鼠和P301L小鼠海马CA1区慢γ节律和快γ能量都较正常组降低[82-83].此外在APP-KO、P301L、APP-23等模型小鼠中发现θ与快γ和慢γ节律之间的相位振幅耦合程度均减弱[82-86],其中以快γ的减弱程度尤为显著[83-86].在这些研究中发现海马脑区位置细胞的放电与慢γ节律之间的相位锁定较正常组弱[82],这可能导致了位置细胞放电与位置信息之间的相关性显著降低[82-83].此外皮层区的γ节律被认为可以增强神经环路中信息的传递[7],而不同神经节律的交叉耦合参与大脑的学习、记忆功能.在AD的h APPJ20模型小鼠中发现顶叶皮层的γ节律(30~80 Hz)能量下降[87],前额叶皮层PFC区的θ与CA1区快γ的交叉频率耦合异常[86],APP-PS1小鼠的运动皮层M1区[88]和APP转基因小鼠的海马区[85]慢γ节律能量升高.在静息态下APOE4-KI小鼠和5×FAD小鼠海马CA1的慢γ节律[89-90]、5×FAD小鼠的快γ节律[91]能量均降低;θ与慢γ节律[91]、快γ节律[86]之间的交叉频率耦合程度减弱.静息态下海马CA3区也发现慢γ节律的能量降低[90],齿状回慢γ节律能量降低[90],快γ能量增加且θ-慢γ交叉频率耦合异常[91].APP-KI小鼠内嗅皮层的θ与快γ节律交叉频率耦合受损[92],TgF344大鼠前额叶皮层处的慢γ能量降低而θ与快γ节律的交叉频率耦合受损[93].这些研究表明,AD模型鼠的神经节律损伤特征主要表现为海马脑区及相关皮层区快γ和慢γ的能量下降以及他们与θ节律的交叉耦合程度减弱.
| 图表编号 | XD00170057500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.20 |
| 作者 | 白杨、杨佳佳、郑晨光 |
| 绘制单位 | 天津大学医学工程与转化医学研究院、天津大学医学工程与转化医学研究院、天津大学精密仪器与光电子工程学院、天津市脑科学与神经工程重点实验室、天津大学医学工程与转化医学研究院、天津大学精密仪器与光电子工程学院、天津市脑科学与神经工程重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式