《表1 一些化学键解离能及自由基的电子亲和能》
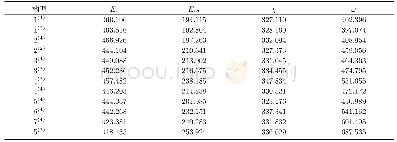
对于所有质子酸,都有I(H)项,且均解离出一个H+,因此熵效应十分接近,所以在气体状态时比较酸碱性只要比较化学键A-H的稳定性以及A-的稳定性,也就是比较[D(A-H)-EA(A)]的大小,就可以判断出酸在气体状态下的相对强弱。以第二周期非金属氢化物和卤素氢化物为例,用这些数据可以很好地解释气态非金属元素氢化物的酸碱性规律,见表1[11](解离能和电子亲和能数据均取自文献[11]):同族元素从上到下EA(A)值差异很小,而D(A-H)因原子半径的显著增加而迅速减小,因此,从上到下同族元素的气态氢化物HA的[D(A-H)-EA(A)]值依次降低,所以HA(g)的酸性增强,此时只使用D(A-H)也能得出酸性强弱变化规律;而同周期元素从左到右D(A-H)值差异小,而EA(A)值差异大,且迅速减小,因此,从左到右同周期元素的气态氢化物HA的[D(A-H)-EA(A)]值依次降低,所以HA(g)的酸性增强,此时只使用EA(A)的值也能得出酸性强弱变化规律。而如果考虑水溶液中的情况,则还涉及过程(7)–(9),分别对应A-的水合热和H+的水合热:
| 图表编号 | XD0016399400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2018.04.28 |
| 作者 | 刘绍乾、王稼国、钟世安 |
| 绘制单位 | 中南大学化学化工学院、温州大学化学与材料工程学院、中南大学化学化工学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式