《表5 双峰驼NGB蛋白基本理化性质》
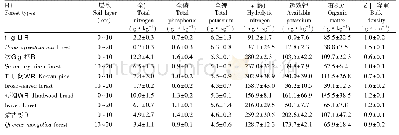
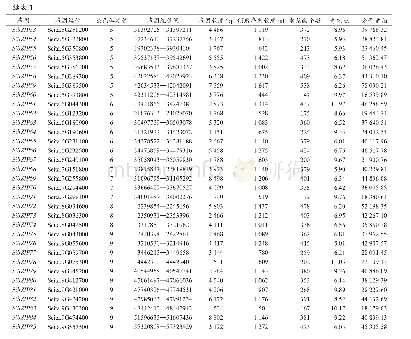
蛋白质的理化性质包括相对分子质量、等电点等。由表5可知,利用Protparam工具分析得到双峰驼NGB相对分子质量17 076.62,pI值5.39,半衰期30 h,其不稳定系数56.50,大于40即为不稳定性的蛋白,所以预测NGB具有不稳定性;根据Protean结果,用Prostscale程序计算NGB基因编码产物的疏水性/亲水性,分析氨基酸残基的得分可知,在分析残基中第72位异亮氨酸中表现最强亲水性(-2.54),在第3位丙氨酸中表现为最强疏水性(1.81),推断整条多肽链氨基酸序列表现为亲水性。其总平均亲水性为-0.108,说明该蛋白整体呈现亲水性,是可溶性蛋白。
| 图表编号 | XD00147979900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.01 |
| 作者 | 杜晓华、米晓钰、胡桂玲、王海芳、刘霞 |
| 绘制单位 | 甘肃农业大学动物医学院、甘肃农业大学生命科学技术学院、甘肃农业大学动物医学院、甘肃农业大学生命科学技术学院、甘肃农业大学生命科学技术学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式