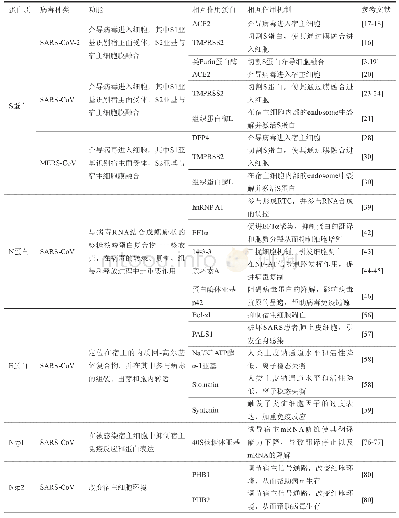
《表1 β属冠状病毒S蛋白异同点》
SARS‐CoV‐2的S蛋白是一种糖蛋白,位于病毒表面,是病毒的融合蛋白,负责冠状病毒与宿主细胞受体结合,介导SARS‐CoV‐2感染的第一步[23]。在某些情况下,S蛋白也能在感染后期诱导细胞‐细胞融合。SARS‐CoV和MERS‐CoV的S蛋白不同的是二者与宿主细胞结合的关键受体分别为人类血管紧张素转化酶Ⅱ(Angiotensin‐converting enzymeⅡ,ACE2)和二肽基肽酶4(Dipeptidyl peptidase 4,DPP4)。对SARS‐CoV‐2的S蛋白序列分析表明,虽然与SARS‐CoV的S蛋白之间有区别,但是同源性很高[3,24]。与SARS‐CoV的S蛋白相比发生了27个氨基酸替换,其中S1的受体结合结构域(Receptor‐binding domain,RBD)上的357~528位有6个替换,569~655位的支持亚区有6个替换[21],有多个研究团队通过生物信息学预测、结构分析和体外实验等方法,证明SARS‐CoV‐2与SARS‐CoV使用相同的宿主受体ACE 2,而不使用MERS‐CoV的宿主受体DPP4[3,10,25]。最近,SARS‐CoV‐2的S蛋白胞外融合区的冷冻‐电镜原子结构结果显示,与其他冠状病毒的S蛋白一样,它包括S1和S2两个亚基,组成一个同源三聚体结构,且在感染过程中,在S1/S2裂解位点均被宿主细胞蛋白酶加工[26,27]。在切割之后,S蛋白被分为识别同源细胞表面受体的N端S1‐胞外结构域和参与病毒进入的C端S2‐膜锚定蛋白。S1亚区有三个RBD,位于核心内部的二硫键连接的RBD结构,在β属冠状病毒中保守[26‐28]。但有趣的是,SARS‐CoV‐2与其他β属冠状病毒不同的是(表1),其S蛋白的RBD结构则更靠近三聚体的中央部位,其3个RBD中的1个会向上螺旋,突出的插入序列让S蛋白形成能够轻易与宿主受体ACE2结合的空间构象[11,29,30],提示其传染性更强[30]。另外,在S蛋白上发现了一个特殊的Furin样切割位点位于S1和S2亚区之间,这是其他SARS样冠状病毒所没有的,而高致病性禽流感H5N1的血凝素(Hemagglutinin,HA)上也有一个类似的插入位点[29],扩大了病毒的组织嗜性。因此,SARS‐CoV‐2的S蛋白上这一插入位点可能在病毒的生命周期和致病机制中发挥重要作用。
| 图表编号 | XD00145036900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.01 |
| 作者 | 谢茜、伍政宇、舒跃龙 |
| 绘制单位 | 中山大学公共卫生学院(深圳)、中山大学公共卫生学院(深圳)、中山大学公共卫生学院(深圳) |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式