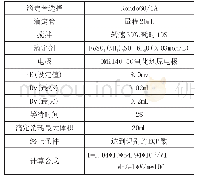
《表1 不同测定条件下游离盐酸电位滴定结果的对比》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《电位滴定法测定Ruthner法盐酸再生工艺流程酸洗液中游离盐酸浓度》
准备两个250mL烧杯,分别加入一定量0.1mol/L盐酸标准溶液,使其中的游离盐酸含量与0.5mL上述选取的酸洗液样品中的游离盐酸含量相等,得到两份不加样品的盐酸浓度测定液,其中一份加100mL水,采用实验方法进行测定得到图1中曲线1,另一份加入10mL Ca-CaY溶液和100mL水,采用实验方法进行测定得到图1中曲线2;取0.5mL上述选取的酸洗液样品,加入10mL Ca-CaY溶液和100mL水,采用实验方法进行测定得到图1中曲线3;取0.5mL上述选取的酸洗液样品,加入100mL水,采用实验方法进行测定得到图1中曲线4。将上述4组曲线叠加以考察Fe2+和Fe3+对测定的影响以及Ca-CaY溶液掩蔽Fe2+和Fe3+的效果。并将上述4种情况下的测定结果列于表1。由表1可见,由盐酸和“盐酸+Ca-CaY”两种体系下的测定结果对比可知,两种体系下的测定值均与参考值基本一致,这说明加入Ca-CaY溶液作为掩蔽剂对测定结果的影响可忽略;由盐酸和样品两种体系下的测定结果并结合文献[2-6]可知,样品体系下的测定结果比参考值偏高,而盐酸体系下的测定值与参考值基本一致,这说明样品中Fe2+和Fe3+对测定有正干扰;由样品和“样品+Ca-CaY”两种体系下的测定结果对比可知,样品体系下的测定结果比参考值偏高,而“样品+Ca-CaY”体系下的测定值与参考值基本一致,这说明加入Ca-CaY溶液作为掩蔽剂可以消除Fe2+和Fe3+对测定的干扰。结合表1数据,并观察图1中曲线可知:曲线1中,盐酸体系滴定起始pH值在2左右,滴定曲线的滴定突跃范围为pH=3.5~10;曲线2中,“盐酸+Ca-CaY”体系滴定初始阶段H+与EDTA结合使起始pH值抬高,其初始pH值在3.5左右,并且滴定曲线突跃范围变窄,其突跃范围为pH=5~9;曲线3中,“样品+Ca-CaY”体系滴定初始pH值在3.5左右,在滴定过程中首先试液中的游离H+被滴定,pH=6附近时出现一个小的突跃;随着滴定剂的加入,Fe2+和Fe3逐步取代EDTA所吸附的H+,pH值缓慢上升,当取代完全后,测定液中H+被全部滴定,pH=7~9处产生一个较大突跃,这说明测定终点到达;曲线4中,样品体系在pH=4附近发生小的突跃,此时溶液有氢氧化铁部分析出,试液浑浊。
| 图表编号 | XD00141645100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.03.01 |
| 作者 | 陈敏、朱子平 |
| 绘制单位 | 宝山钢铁股份有限公司制造部、宝山钢铁股份有限公司制造部 |
| 更多格式 | 高清、无水印(增值服务) |