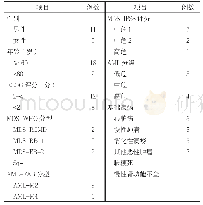
《表1 急性髓系白血病中存在的突变及其发生率》
近年来,随着对AML发病机制的不断深入了解,诱发AML的许多异常基因也逐渐明晰。由表1可知,在AML中,最为常见的基因突变包括FLT3、C-KIT、NPM1、RAS及DNMT3A。因此,不断深入研究这些基因突变的机制及突变靶点,在AML的个体化、靶向性治疗中发挥重要的作用。除此之外,与AML的发生和发展密切相关的基因突变及基因融合还包括与DNA甲基化相关基因异常如TET2和WT1;组蛋白修饰异常如ASXL1、MLL改变、EZH2和KMT2A;AML1点突变以及TEL-PDGFRβ基因融合等。目前,基于本文所述基因改变的靶位,已有许多的靶向药物被批准应用于临床或正处于临床试验阶段。针对持续性激活酪氨酸激酶的基因突变,如对于FLT3基因突变的靶位,研发出酪氨酸激酶抑制剂(TKI),首个上市的伊马替尼能有效作用于KIT基因8号外显子的突变,但其对17号外显子的D816V突变无效,此时就应该根据TK基因突变的类型及突变靶点合理选择第2代TKI达沙替尼、进入临床试验阶段的Quizartinib和Crenolanib以及多靶向酪氨酸激酶抑制剂(包括2017年4月28日美国食品药品监督管理局批准上市用于联合化疗治疗FLT3阳性的米哚妥林和索拉非尼)等;针对RUNX1-RUNX1TI、CBFβ-SMHHC和PML-RARα融合基因所引起的CBF功能缺失性突变,分别开发出有效的小分子靶向苯二氮?类物质Ro5-3355、小分子靶向抑制剂AI-10-49和全反式维甲酸等;针对靶向阻止CEBPA磷酸化和逆转PML-RARα对CEBPA活性抑制,分别研发出丝裂原活化蛋白激酶/细胞外信号调节激酶(MAP/ERK)与FLT酪氨酸激酶抑制剂和全反式甲维酸;针对IDH1/2基因突变的靶向抑制剂包括正处于临床试验阶段的IDH1抑制剂Ivosidenib(AC-120)和2017年8月1日美国食品药品监督管理局批准上市的IDH2基因突变抑制剂恩西地平,而且对于IDH基因突变后所致的2-HG这一过量中间代谢产物,可作为AML疾病诊断、发展及治疗过程中的一种潜在生物标志物;而对于近年来发现的与AML的发生、发展密切相关的DNMT3A R878H功能缺失性突变,虽还未有针对该基因突变的靶向药物,但这也为今后AML的临床治疗提供了潜在靶点;对于NUP98-HOXA9这类功能缺失性突变,具体的发病机制需要进一步深入研究,这也可能是未来研发靶向治疗药物潜在的新靶点。“二次打击”学说指出,每一类突变中至少存在一种基因突变或染色体畸变,并且通过协同作用影响多种原癌基因、抑癌基因、抗凋亡基因等,最终导致AML。诸如,NPM1突变的AML患者中常伴有FLT3-ITD基因突变,而在IDH1/2基因突变中伴随着FLT3-ITD和(或)NPM1基因突变;RAS基因突变多见于伴有inv(16)和abn11q23核型异常的患者中,少见于伴有t(15;17)核型异常的患者中,而N-RAS基因突变少见于伴有MLL/11q23重排的患者中等等。因此,临床上往往是由于多种基因或染色体联合突变诱发各种AML亚型,所以在治疗AML时,并不能只考虑单一靶向药物,而是应该充分考虑多靶点的靶向药物共同联合使用,同时多靶点的基因靶向药物将会是今后医药行业的研究重点。迄今为止,虽然临床治疗AML已经取得一定的成效,但是其复发性、多药耐药性、预后效果差等不足仍为AML的临床治疗增加了极大的难度,也是人类目前的挑战之一。
| 图表编号 | XD00125208300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.15 |
| 作者 | 宋慧慧、李明春 |
| 绘制单位 | 大连医科大学药学院、中国人民解放军海军第九七一医院药剂科、中国人民解放军海军第九七一医院药剂科 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式