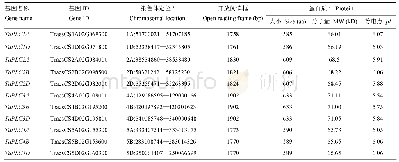
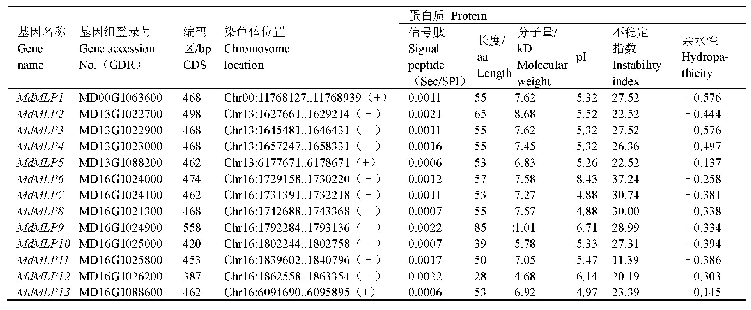
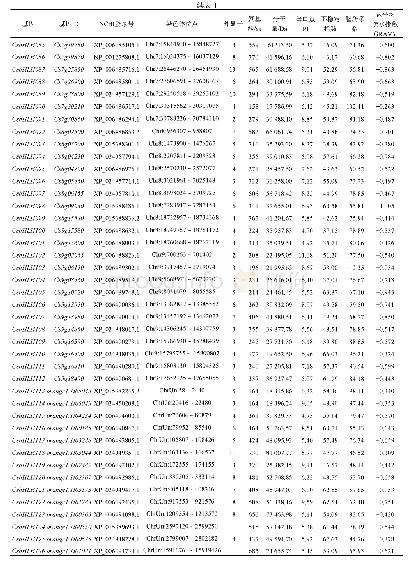
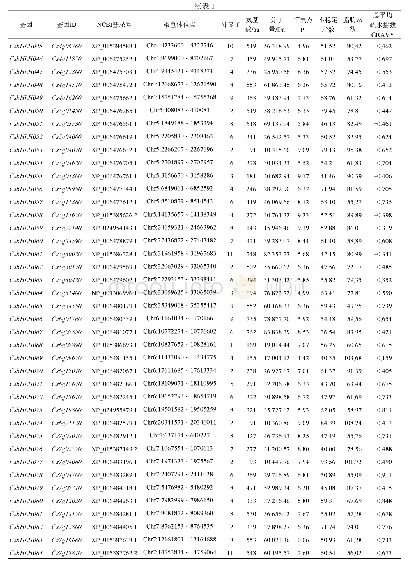
《表2 Metacaspases及其家族成员的生化特性》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《海洋浮游植物metacaspase蛋白酶研究进展》
Metacaspases及其家族成员在生化特性上具有较大的差异(表2)。C14蛋白酶通常以无活性酶原形式存在,在接受刺激信号后会被激活,已证明caspases通过二聚化作用在p20与p10之间进行自我切割而发生激活,同时脱除N端前结构域;Ⅰ型paracaspases活化过程执行的二聚化作用不发生切割且N端前结构域(包括DD与类Ig结构域)不脱除,Ⅰ型与Ⅱ型metacaspases活化过程均不形成二聚体,以单体形式通过自我催化作用进行活化,由于Ⅰ型metacaspases具有N端前结构域,因此活化时发现有些会脱除[7,27]且自我催化具有高度的Ca2+依赖性(除At MC9外)[28]。在蓝隐藻(Guillardia theta)Ⅲ型metacaspases中发现两个钙结合位点,在酶催化过程中需要低摩尔浓度(mM)的Ca2+方可启动自我催化进程[29],显示出metacaspsaes对Ca2+的依赖性。有趣的是,仅在Ⅰ型与Ⅱ型metacaspases的N端发现保守的额外半胱氨酸Cys,它可在酶原形式下经过自我催化后维持蛋白水解活性[30]。一些研究还表明,metacaspases及其家族成员的活性同时还会受到胞内离子[31]、pH[32]、翻译后修饰(如泛素化、磷酸化、亚硝基化等)以及与其他蛋白质的直接相互作用等[30,33-34]方面因素的影响。
| 图表编号 | XD00102134200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.15 |
| 作者 | 姚绍嫦、潘东进、高程海 |
| 绘制单位 | 广西中医药大学海洋药物研究院、广西中医药大学海洋药物研究院、广西中医药大学海洋药物研究院 |
| 更多格式 | 高清、无水印(增值服务) |