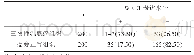
《表1 金纳米粒药物传递系统在三阴性乳腺癌(TNBC)治疗中的应用》
ZD6474-Au NPs:双酪氨酸激酶抑制剂-两亲性共聚物-金纳米粒,NACLAT1-Au NPs:中性氨基酸转运体1-金纳米粒,Fu-AUNPs:氟尿嘧啶-金纳米粒,DOX-LDGI-NPs:多柔比星-金纳米粒-氧化铁等离子体磁性混合纳米粒,si R34a-LBL-Au NP:si R34a层装金纳米粒,si R708-Au NP:si R708多层金纳米粒,
肿瘤干细胞为肿瘤复发和频繁转移根源所在。TNBC常规方式化疗仅仅能够缩小肿瘤肿块,对肿瘤干细胞抑制杀灭作用不明显,Au NPs包覆的多孔硅微粒负载多西紫杉醇,近红外刺激下通过温和热疗释放多西紫杉醇杀死大部分肿瘤细胞和肿瘤干细胞[19]。DNA合成期肿瘤细胞对叶酸的需求量加大,需要通过叶酸-转铁蛋白(TF)摄取细胞外叶酸来维持,周期特异性肿瘤抑制药吉西他滨主要干扰DNA合成期的细胞,Au NPs借助p H敏感的酰胺键将吉西他滨固定于纳米药物载体,有效阻止药物在生理条件(p H=7.4)下代谢及正常组织细胞的摄取,利用表面增强拉曼散射光谱来监测吉西他滨负载到纳米载体上的情况可实施药物释放监控。MDA-MB-231细胞株体外实验证实经Au NPs负载吉西他滨和叶酸-TF配体的纳米载体,靶向控制释放药物,可减少药物的副作用并提高其功效,该系统适合靶向肿瘤细胞及肿瘤干细胞的高剂量给药[20]。干扰小RNA(small interfering RNA,si RNA)通过下调相关基因抑制肿瘤干细胞增殖。聚乙烯亚胺修饰的Au NPs(Au NPPEI)有效递送si RNA进入肿瘤细胞,经TNBC原位肿瘤模型证实EFE-2K、Src和MAPK-ERK增殖信号通路受到明显抑制[21]。此外,Au NPs构筑的递药系统通过负载双酪氨酸激酶抑制剂[22]、顺铂、多西紫杉醇[23]、氟尿嘧啶[24]、光敏剂[25]、多柔比星[26]、肿瘤生长抑制基因片段[27]和肿瘤转移抑制基因片段[28]等,通过不同的作用机制抑制肿瘤的增殖和转移,有效遏制肿瘤生长、转移和复发,详见表1。
| 图表编号 | XD0096920800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.25 |
| 作者 | 张敏娜、王光辉 |
| 绘制单位 | 济宁医学院药学院、济宁医学院药学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
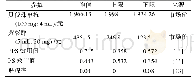

![表1 临床病理特征在三阴性乳腺癌与非三阴性乳腺癌患者间的比较[例(%)]](http://bookimg.mtoou.info/tubiao/gif/ZLYD202005004_02600.gif)