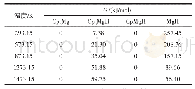
《表1 各反应式在不同温度下产物与反应物的Gibbs自由能差ΔG》
图5显示了[MMGNH]2的形成和分解路径在不同温度下的Gibbs自由能变化。从图5中可以看出,反应G4只在T=1473.15 K下,ΔG为负值,其余皆为正值。这说明DMGNH2只有在高温下,才能分解为MMGNH。在此温度下的活化自由能ΔG*很高,约为305 kJ/mol。这意味着反应G4的反应速率较慢。MMGNH后续分解(G5、G6和G7)的自由能差ΔG,如表1所示。从表1中可以看出,在计算温度范围内,反应G6、G7的自由能差ΔG<0,但反应G5的自由能差ΔG>0。因此,MMGNH脱去CH4,变为GaN分子,最终聚合为[GaN]2和[GaN]3,这条路径是热力学不利的。
| 图表编号 | XD0089098200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.01 |
| 作者 | 张红、唐留 |
| 绘制单位 | 江苏大学能源与动力工程学院、江苏大学能源与动力工程学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式