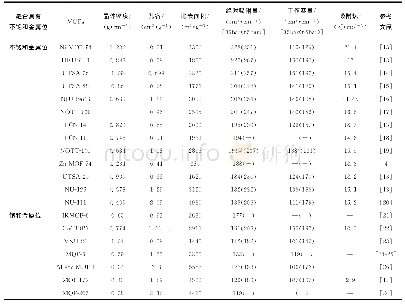
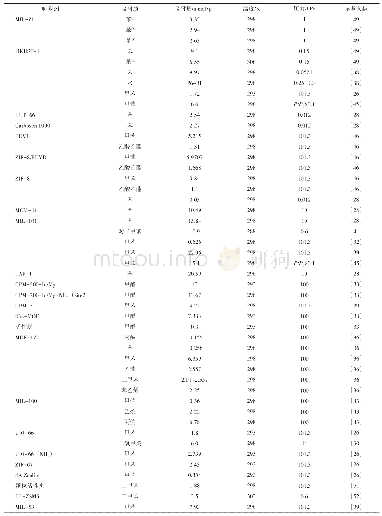
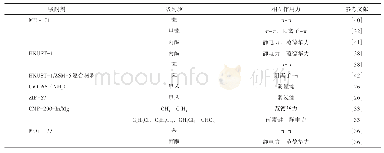
《表1 原始MOFs及改性MOFs材料对铀的去除效果以及机理》
注:—表示文章没有提供数据或没有描述。exp表示qmax是通过实验得出来的,而非通过Langmuir方程计算出来的。(1)表示实验条件是人造海水,p H=7.8,铀浓度为6μg/L,固液比10mg/L;(2)表示实验条件是渤海海水,固液比1mg/L,3天,室温;(3)表示实验条件是真实海水,pH=8.3,
批实验技术是研究吸附机理技术中应用最广泛的方法之一,并被认为是极其方便和有效的[87]。这种方法主要是研究溶液pH、固液比、平衡时间、实验温度等因素对材料吸附性能的影响。其中溶液的p H对吸附实验起关键作用,显著地影响金属离子的形态以及吸附剂表面的电荷分布;对于MOFs吸附铀的实验,溶液的pH还影响着MOFs晶体结构的稳定性。以MIL-101-COOH为例[52],在pH=1~12范围内,对铀(Ⅵ)的吸附具有很强的pH依赖性;在p H低于3时,非常少的铀酰离子吸附在MIL-101-COOH上;接着吸附容量随着pH的增大而明显增加,在pH=5~10范围内达到最大值;pH大于10时吸附容量又急剧下降。这种影响可以解释为溶液pH导致MOFs嫁接上的羧基发生了质子化和脱质子化,从而影响了UO22+与MIL-101-COOH的静电吸引作用;并且在较高pH下,铀(Ⅵ)出现了多种多核氢氧化物[如(UO2)2(OH)22+、(UO2)3(OH)5+、(UO2)4(OH)7+、(UO2)(OH) 7-],也影响了铀的吸附。从表1可以看出,MOFs对铀(Ⅵ)吸附的最优pH一般都在2~9这种弱酸或中性的范围内。但是SZ-2和SZ-3是个例外,在pH=1的水溶液中不但能稳定存在,还有很好的除铀能力[51]。
| 图表编号 | XD0064470500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.07.05 |
| 作者 | 彭莹、张晓文、李密、张宇、吴晓燕 |
| 绘制单位 | 南华大学资源环境与安全工程学院、南华大学资源环境与安全工程学院、南华大学资源环境与安全工程学院、南华大学资源环境与安全工程学院、南华大学资源环境与安全工程学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式