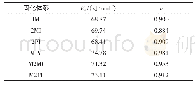
《表2 单体各反应物、过渡态经过零点能矫正后的总能量、反应活化能及对比误差》
注:反应活化能=过渡态能量-反应物能量。
图2给出了单体的5条热解反应路径,图3是每条路径的焓变ΔHk随温度的变化情况,图4是自由能变ΔGk随温度的变化情况。表2是通过GGA/BP算法对图2中的5条路径的各反应物、产物、过渡态经过几何优化后得到的能量及反应势垒。图2a是path1的热解过程,单体上的C3—C5键发生断裂,生成了活性较强的甲基和比较稳定的丁二烯基,这一步的反应势垒为437.50kJ/mol,与文献中的375.06kJ/mol相比误差为16.5%(见表2),而且从图3中可以看出path1的ΔHk基本在500kJ/mol以上,远大于其他4条路径,并且温度为500K时出现了最大值。经过分析,发现相对质量小的分子,温度低时对其焓值影响程度较小,变化范围不大,温度高时变化范围加大,此路径中有甲基,在对产物和反应物作差时就出现了一个最大值。从图4中也可以看出,path1的ΔGk都位于320kJ/mol以上,远高于其他4条路径。图2b中path2、3都是发生的氢自由基攻击单体夺取氢的反应,不过path2是活性较强的氢自由基攻击单体C5H8,导致乙烯基上的C—H键发生断裂,然后与氢自由基结合生成H2,此步的反应势垒为21.37kJ/mol,而path3则是氢自由基攻击单体C5H8,导致丙烯基上的烯丙基键C—H键发生断裂,然后与氢自由基结合生成H2,此步的反应势垒为5.78kJ/mol。通过比较path2与3可以看出,path3的势垒小于path2的势垒,说明破坏烯丙基键比破坏乙烯基键更容易。这是因为乙烯基键C—H的键能(412kJ/mol)大于烯丙基键C—H的键能(362.5kJ/mol)。从图3、4中也可以看出,path3中在每个温度下的ΔHk和ΔGk都小于path2,这都说明path3比path2更有竞争力。图2c中的path4、5发生的则是甲基攻击单体夺取氢的反应,其中path4是甲基攻击单体C5H8,导致乙烯基上的C—H键发生断裂,然后与氢自由基结合生成CH4,这一步的反应势垒为50.07kJ/mol,与文献中的46.67kJ/mol比较接近(见表2);path5则是甲基攻击单体C5H8,导致丙烯基上的烯丙基键C—H键发生断裂,然后与氢自由基结合生成CH4,这一步的反应势垒为18.45kJ/mol,接近于文献中的19.18kJ/mol(见表2)。比较发现,path5的势垒小于path4的势垒,说明path5比path4有竞争力,也进一步证明了乙烯基键比烯丙基键稳定。图3、4中的ΔHk和ΔGk也是path5的值都要小于path4的值。比较path3、5可以发现,同样是与丙烯基上脱离的氢自由基结合,path3需要突破的势垒小于path5的势垒,说明氢自由基的活性强于甲基的活性。通过比较5条反应路径的势垒发现,path1>path4>path2>path5>path3,所以从动力学角度看,优先支持的路径是path3。同样地,按ΔGk从大到小的顺序排列:当温度低于850K时,path1>path4>path2>path5>path3,热力学上优先支持的路径顺序为path3>path5>path2>path4>path1;温度高于850 K时,path2要优于path5。结合动力学和热力学计算结果可以看出,在单体的热解过程中,path3是主要的热解反应通道,H2是主要的产物。
| 图表编号 | XD0043907300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.10 |
| 作者 | 杨启容、邹瀚森、魏鑫、姚尔人、钟浩文、禹国军 |
| 绘制单位 | 青岛大学机电工程学院、西安交通大学能源与动力工程学院、青岛大学机电工程学院、青岛大学机电工程学院、青岛大学机电工程学院、上海交通大学船舶海洋与建筑工程学院、上海海事大学商船学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式


![表2 对比两组患者经过治疗后的不良反应发生率[n(%)]](http://bookimg.mtoou.info/tubiao/gif/ZHJK202008060_02300.gif)
