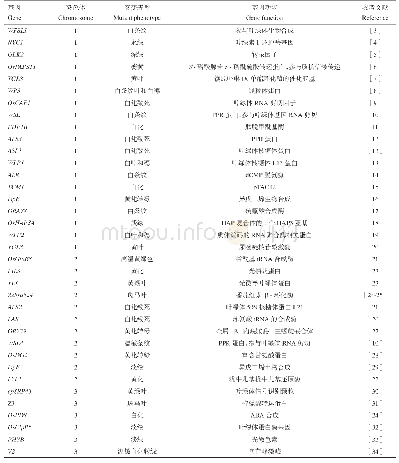
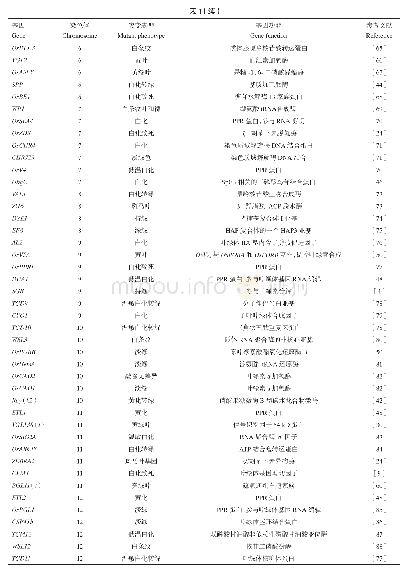
《表4 已克隆的植物Sec14-GOLD基因及特征》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《植物Sec14-like磷脂酰肌醇转运蛋白:变化的结构和多样的功能》
GOLD结构域是最早在分泌囊泡受体p24家族蛋白中发现的,存在于涉及高尔基体功能和囊泡运输的几种蛋白质中,可能与蛋白质-蛋白质相互作用相关(Anantharaman,Aravind,2002)。由于GOLD结构域以β折叠直接与Sec14p结构域结合(图1),因此与Sec14-nodulin proteins相比,Sec14-GOLD proteins和酵母Sec14p的相关性更高。目前发现的植物Sec14-GOLD proteins主要集中在拟南芥上,其基因组中存在6个N端具有Sec14p结构域且C端具有GOLD结构域的Sec14-GOLD proteins,包括PATL1、PATL2、PATL3、PATL4、PATL5和PATL6(Mcreynolds,Luna,2004),其中PATL1、PATL2、PATL3和PATL6已经克隆(表4)。该类蛋白氨基酸数目约为400~700 aa,蛋白大小约为40~150 kD(表4)。拟南芥PATLl是一个质膜外周蛋白,在新生细胞中,PATLl从质膜转运到有丝分裂末期的细胞板上,并特异地结合参与质膜运输的一些重要调节物质,如PtdIns、PtdIns5P、PtdIns(4,5)P2和Ptd Ins3P,从而参与细胞板的延伸和细胞内膜组分的运输(Mcreynolds,Luna,2004)。研究发现,PATL1能结合PI及其他几种(PtdIns5P,PtdIns (4,5)P2和Ptd Ins3P) 磷酸化产物,但对PtdIns(3,4)P2没有亲和力(Mcreynolds,Luna,2004),相反PATL2能结合所有PI的磷酸化产物唯独不能结合PI本身(Takamasa et al.,2016),这些结果表明PATL1和PATL2可能通过不同磷酸化方式调控脂质信号传导(Takamasa et al.,2016)。尽管如此,拟南芥PATL1和PATL2蛋白在胞质分裂过程中都定位在细胞板上,并且二者在细胞内的积累均受到油菜素类固醇(brassinosteroids)处理的影响(Deng et al.,2007),表明两者可能参与类似的细胞过程(Takamasa et al.,2016)。为探索PATL3与拟南芥Exocyst亚基EXO70A1相互作用的意义,Wu等(2017)通过双分子荧光互补技术发现PATL3-GFP和EXO70A1-mCherry共定位于质膜和细胞板上,且PATL3从质膜到细胞板的转运不通过内膜系统,而是与EXO70A1直接互作被募集到膜上。拟南芥Sec14-GOLD proteins,如Patellin3和Patellin6,除与胞质分裂相关外,还参与病毒的互作。这两个基因在整个植物生长期包括根、花、角果和种子中均有表达(Winter et al.,2007),过表达PATL3和PATL6会影响移动蛋白(movement proteins,MP)靶向胞间连丝,进而减轻其感染的作用,同时在PATL3和PATL6的单突变体或双突变体中MP的RNA表达水平升高,而病毒基因组在细胞间的运输需要与宿主细胞骨架和内膜系统的MP相互作用(Boevink,Oparka,2005),表明PATL3和PATL6蛋白与苜蓿花叶病毒(Alfalfa mosaic virus,AMV)MP的相互作用影响病毒复合体靶向和穿过胞间连丝,进而干扰病毒运动(Peiro et al.,2014)。
| 图表编号 | XD0038777000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.25 |
| 作者 | 毛花英、苏亚春、阙友雄 |
| 绘制单位 | 福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室、福建农林大学教育部作物遗传育种与综合利用重点实验室、福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室、福建农林大学教育部作物遗传育种与综合利用重点实验室、福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室、福建农林大学教育部作物遗传育种与综合利用重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |