《Table 2 Calculate the binding free energy of a protein-ligand complex using MM-GB/SA methods》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《基于分子动力学模拟提高嗜热磷酸三酯酶样内酯酶非特异性底物活力的理论研究》
a.ΔGpolar=ΔEele+ΔGGB;b.ΔGnonpolar=ΔEvdW+ΔGSA;c.ΔHMM-GB/SA=ΔEele+ΔGGB+ΔEvdW+ΔGSA;d.ΔGbind=ΔHMM-GB/SA-TΔS;e.kcat/Km(catalytic efficiency)values obtained from the experimental data[11].
MM-GB/SA总结合自由能结果列于表2.可见,WT-lactone的结合自由能为负值(ΔGbind=-27.43k J/mol),低于WT-paraoxon(ΔGbind=20.95 kJ/mol),其中在对氧磷结合的复合物中,有利于底物结合的焓变(ΔHMM-GB/SA=-56.62 kJ/mol)贡献小于内酯结合的复合物(ΔHMM-GB/SA=-108.23 kJ/mol),而两者中不利于底物结合的熵变(-TΔS)贡献相似,因此,焓变决定了Sso Pox催化内酯的效率更高.Trp263突变之后,W263T-lactone的结合自由能(ΔGbind=-63.57 kJ/mol)低于WT-lactone的自由能,其中W263T-lactone中的焓变贡献增大而熵变贡献减小;W263F-paraoxon的结合自由能(ΔGbind=-10.04kJ/mol)同样低于WT-paraoxon,尽管在突变之后熵变贡献增大更加不利于底物的结合,但其有利于底物结合的焓变贡献足以抵消熵变,最终底物与蛋白的结合自由能更低.因此,W263T/W263F的突变能够使底物更加稳定地结合到蛋白质的活性口袋中,底物分子与亲核试剂之间的作用力增强进而促进催化反应进行,与文献中的实验结果一致[11].
| 图表编号 | XD0031436700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.10 |
| 作者 | 朱镜璇、于正飞、刘野、詹冬玲、韩佳睿、田晓翩、韩葳葳 |
| 绘制单位 | 吉林大学生命科学学院分子酶学工程教育部重点实验室、吉林大学生命科学学院分子酶学工程教育部重点实验室、吉林大学生命科学学院分子酶学工程教育部重点实验室、吉林农业大学食品科学与工程学院、吉林大学生命科学学院分子酶学工程教育部重点实验室、吉林大学生命科学学院分子酶学工程教育部重点实验室、吉林大学生命科学学院分子酶学工程教育部重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
查看“Table 2 Calculate the binding free energy of a protein-ligand complex using MM-GB/SA methods”的人还看了
-
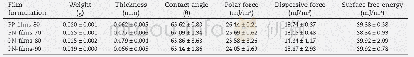
- Table 2–Weight, thickness, contact angle, polar force, dispersive force and surface free energy of PP-films and PN-films
-

- Table 1 Inhibitory activities, free energy of binding, H-bond interactions, and hydrophobic interactions between triterp





