《表4 2014年4月—2019年9月MHRA评估EAMS申请的情况个》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《探索我国罕见病患者药物可及的新途径:疫情下的同情用药制度》
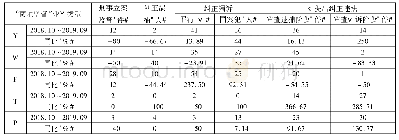
制药公司在向MHRA提交非临床和临床Ⅰ/Ⅱ期数据,并申请PIM之后,提交EAMS申请材料(包括申请表、药物警戒体系文件摘要、风险管理计划等)之前,公司与MHRA将通过召开提交前会议(pre-submission meeting),与英国国立卫生研究院(National Institute of Clinical Excellence,NICE)、国家医疗服务体系(National Health Service,NHS)就该产品是否适合继续申请EAMS进行讨论,并由MHRA发表科学意见。但是,最终还是由申请人决定是否继续进行申请EAMS。在此过程中,MHRA通过2步评估过程提供科学意见:(1) PIM指定。(2)就试验性药物是否适合申请EAMS提供科学意见。从2014年4月至2019年9月MHRA发表科学意见情况如表4所示。其中,2015—2018年批准的22个EAMS中,4个为罕见病用药,占比18%[19]。
| 图表编号 | XD00229677700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.30 |
| 作者 | 袁妮、周娜、蒋蓉、胡骏、王勇 |
| 绘制单位 | 中国药科大学国际医药商学院、大连医科大学公共卫生学院、大连医科大学公共卫生学院、中国药科大学国际医药商学院、上海市食品药品监督管理局科技情报研究所、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |