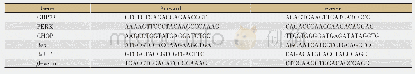
《表1 寄生虫自身的内质网应激反应》
生物信息学分析结果显示,恶性疟原虫(Plasmodium falciparum)完全缺乏转录相关蛋白的同源物(IRE1、XBP1、ATF6、ATF4),但仍然有PERK的同源物,表明其仍有微弱的翻译调节能力[33]。双氢青蒿素的抗疟方式就是通过蛋白损伤以及蛋白酶体功能降低进而对疟原虫起到杀伤作用。当蛋白酶体受损时,多泛素化蛋白累积,同时损伤的与未折叠蛋白累积,激活eIF2α激酶PK4,PK4是哺乳动物PERK的疟原虫同源物,能感受未折叠蛋白。当损伤蛋白不断累积时,其胞浆侧C端的催化区域被激活,磷酸化eIF2α[34-35],eIF2α持续的磷酸化可降低蛋白合成功能并阻碍翻译能力,诱导内质网应激,增强DHA的毒性,并且蛋白酶体的损伤降低了其清除损伤蛋白的能力,两者共同引起恶性疟原虫的死亡[36],见表1。此外,青蒿素及其衍生物(artemisinin and its derivatives,ART)在环状体阶段能够激活PK4,PK4在裂殖体阶段磷酸化eIF2α,降低蛋白合成,从而降低恶性疟原虫对药物的敏感性,并且在ART治疗时引起再发感染,抑制PK4或者eIF2α均可以阻止恶性疟原虫进入潜伏期,引起再发感染[37]。提示在给予青蒿素或青蒿素衍生物治疗疟疾时,通过PK4-eIF2α-蛋白合成能力下降这一作用途径所带来的治疗效果具有双面效应。因此,需要考虑药物对PK4的具体作用的趋势,并且他们的作用效果是否由于疟原虫负荷量与治疗剂量之间的平衡关系,在此过程中找到相应的平衡点,以实现更好的治疗效果。
| 图表编号 | XD00205245100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.28 |
| 作者 | 彭美、沈佳、孙希、吴忠道 |
| 绘制单位 | 中山大学中山医学院寄生虫学教研室、中山大学热带病防治研究教育部重点实验室、中山大学中山医学院寄生虫学教研室、中山大学热带病防治研究教育部重点实验室、中山大学中山医学院寄生虫学教研室、中山大学热带病防治研究教育部重点实验室、中山大学中山医学院寄生虫学教研室、中山大学热带病防治研究教育部重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式