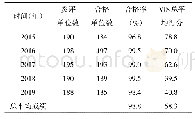
《表1 浙江省2015—2019年注册申报临床体外诊断试剂(盒)相关产品发补内容统计表》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《第二类临床化学体外诊断试剂(盒)注册申报常见问题分析》
按照我国医疗器械监管法规要求,第二类、第三类体外诊断试剂产品在上市前应进行注册审评审批,注册申报资料应符合《医疗器械监督管理条例》(国务院令第680号)、《体外诊断试剂注册管理办法》(国家食品药品监督管理总局第5号)、《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局第6号)、原国家食品药品监督管理总局《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2014年第44号)等相关配套法规规章文件的要求。其中,境内第二类医疗器械(含体外诊断试剂)由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。自2014年新法规实施以来,浙江省技术审评工作严格按照43或44号公告的要求对注册申报资料不符合规定项进行逐一审核发补。现对2015—2019年浙江省内首次注册申报的临床化学体外诊断试剂(盒)发放一次性告知书的626个产品的发补内容进行统计,结果见表1。
| 图表编号 | XD00203346900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.30 |
| 作者 | 杨笑鹤、董沁芳、朱文武、甄辉 |
| 绘制单位 | 浙江省医疗器械审评中心(浙江省医疗器械不良事件监测和安全研究中心)、浙江省医疗器械审评中心(浙江省医疗器械不良事件监测和安全研究中心)、浙江省医疗器械审评中心(浙江省医疗器械不良事件监测和安全研究中心)、浙江省医疗器械审评中心(浙江省医疗器械不良事件监测和安全研究中心) |
| 更多格式 | 高清、无水印(增值服务) |