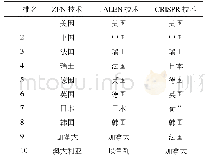
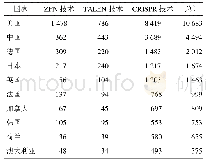
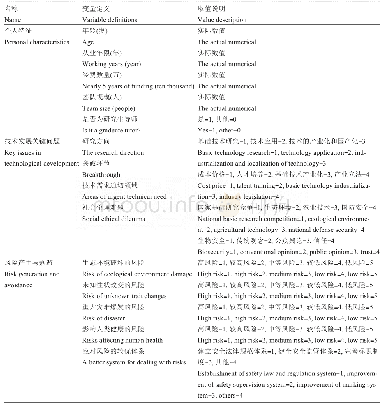
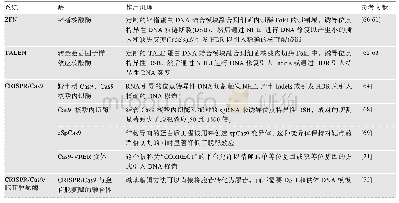
《表1 用于人类i PSCs的基因编辑技术》
可编程位点特异性核酸酶的开发,包括锌指核酸酶(zinc-finger nuclease,ZFN)[64,65]、转录激活物样效应器核酸酶(transcription activator-like effector nucleases,TALENs)[66,67]和CRISPR/Cas9系统[68],通过诱导基因修饰位点的DNA双链断裂,显著提高了人ESCs和i PSCs的基因编辑效率。其中CRISPR/Cas9技术由于设计简单、使用方便等优点,在人类胚胎干细胞和i PSCs的基因编辑中得到了广泛的应用。这种基因编辑技术允许研究人员将致病突变引入非患者i PSCs或消除患者i PSCs中的致病突变,从而创建基于i PSCs的疾病建模等基因控制平台。尽管使用CRISPR/Cas9技术可能会产生偏离目标的效果,如CRISPR/Cas9在肿瘤细胞系[69]中发现了相对较高水平的非靶基因修饰,但来自多个实验室的全基因组测序(whole genome sequencing,WGS)研究表明,非靶基因修饰在正常人类细胞(包括人i PSCs和ESCs)中很少见[70,71]。基因编辑工具也在不断改进和完善,这可能有助于解决脱靶效应的问题。最初CRISPR/Cas9通过诱导DNA双链断裂来编辑一个基因组位点;后来由成对向导RNA或特异性增强的工程化Cas9核酸酶变体(engineered Cas9 nuclease variants with enhanced specificity,e Sp Cas9)指导的Cas9核酸内切酶变体(D10A突变体)越来越多地用于基因组编辑[72],因为这两种方法都能在保持对靶点的严格切割的同时显著降低了脱靶效应[73]。此外,催化死亡的Cas9 (dead Cas9,d Cas9)通过与转录激活剂或抑制因子融合,用于调节内源基因的转录或通过与荧光蛋白融合来成像基因组位点[74]。对CRISPR/Cas9系统的改造也能以精确的单等位或双等位基因的方式高效地引入DNA序列的变化[75]。最近在碱基编辑方面的一个新进展是利用CRISPR/Cas9与胞苷脱氨酶融合,使胞苷直接转化为尿苷而不需要双链DNA断裂[76]。这种新方法提高了基因编辑效率,并将进一步促进人类i PSCs的基因编辑发展。用于人类i PSCs的基因编辑技术以及作用机理如表1所示。
| 图表编号 | XD00199234000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.01 |
| 作者 | 蔡晨依、孟飞龙、饶琳、刘云玥、赵小立 |
| 绘制单位 | 浙江大学生命科学学院遗传与再生生物学研究所浙江省细胞与基因工程重点研究实验室、浙江大学生命科学学院遗传与再生生物学研究所浙江省细胞与基因工程重点研究实验室、浙江大学生命科学学院遗传与再生生物学研究所浙江省细胞与基因工程重点研究实验室、浙江大学生命科学学院遗传与再生生物学研究所浙江省细胞与基因工程重点研究实验室、浙江大学生命科学学院遗传与再生生物学研究所浙江省细胞与基因工程重点研究实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式