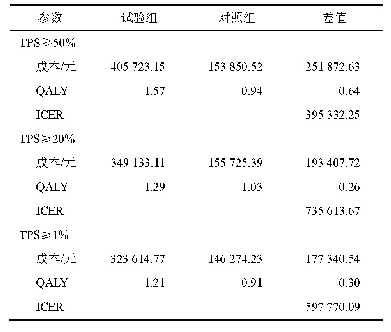
《表1 本研究鉴定帕博利珠单抗抗原表位与已报道的抗原表位对比》
为了验证本研究抗原表位作图结果的准确性,在帕博利珠单抗和PD-1蛋白复合物晶体结构(PDB蛋白数据库:5GGS)上进一步分析了帕博利珠单抗与抗原表位氨基酸的相互作用(图7),结果显示PD-1抗原表位(黄色标记的氨基酸)通过形成氢键和范德华力等方式与帕博利珠单抗重链可变区CDR1的Y33、Y35,CDR2的N52、N55,CDR3的R99、Y101、R102、F103以及轻链可变区CDR1的S32、Y34、Y36,CDR2的Y53、Y57,CDR3的L98相互作用,该结果完全涵盖在Lee等[7]报道的帕博利珠单抗和PD-1蛋白相互作用的氨基酸中。将本研究鉴定出的抗原表位与已经报道的基于晶体结构解析的抗原表位进行对比,发现不同机构对帕博利珠单抗和PD-1蛋白复合物结晶解析出的抗原表位[7–11]略有差异,本研究鉴定出的抗原表位与已报道晶体结构解析的抗原表位高度一致(表1)。
| 图表编号 | XD00194661400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.25 |
| 作者 | 李栋 |
| 绘制单位 | 上海药明生物医药有限公司 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式