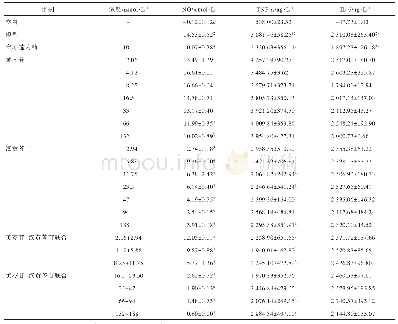
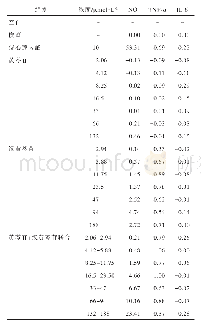
《表3 抑制剂对BFP、F1、F2和F3诱导RAW264.7细胞产生TNF-α的影响a》
注:a将生长培养基中贴壁的RAW264.7细胞(3×104个细胞/孔)接到96孔板中与每种抑制剂(终浓度为20μmol/L)共同在37℃、5%CO2中预孵育1 h,然后将BFP、F1、F2和F3(最终的质量浓度为20μg/mL)加入到细胞中,温育24 h后,采用ELISA测定处理细胞的培养基中TNF-α浓度;bBFP、F
MAPK信号通路和NF-κB信号通路在巨噬细胞活化释放NO和分泌TNF-α过程中起重要作用[40-41]。为阐明MAPK和NF-κB信号传导通路是否参与红毛藻多糖诱导RAW264.7细胞活化释放NO和分泌TNF-α,本文利用ERK MAPK(U0126)、JNKMAPK(SP600125)、p38 MAPK(SB203580)的3种经典MAPK信号通路特异性抑制剂和NF-κB信号通路特异性抑制剂PDTC分别预处理细胞,阻断相应信号通路,来分析参与红毛藻多糖诱导RAW264.7细胞活化释放NO和分泌TNF-α的相关细胞信号通路。抑制剂对BFP、F1、F2和F3诱导细胞活化释放NO和分泌TNF-α的结果如表2和表3所示。抑制剂SP600125和PDTC均显著抑制BFP、F1、F2和F3诱导细胞活化释放NO,而抑制剂U0126只显著抑制BFP诱导细胞活化释放NO(表1)。抑制剂SP600125和U0126均显著抑制BFP、F1、F2和F3诱导细胞活化分泌TNF-α。抑制剂SB203580只显著抑制BFP和F1诱导细胞活化分泌TNF-α,而PDTC对F1诱导细胞活化分泌TNF-α无明显的抑制作用(表2)。以上结果表明,BFP主要通过诱导RAW264.7细胞中NF-κB、JNK MAPK和ERK MAPK信号通路活化释放NO,而诱导NF-κB、ERK MAPK和p38 MAPK信号通路活化分泌TNF-α;F1主要通过诱导细胞中的NF-κB、和JNK MAPK信号通路活化使细胞释放NO,通过诱导JNK、ERK和p38 MAPK信号通路活化分泌TNF-α;F2和F3作用机制相似,主要通过激活细胞的NF-κB和JNK MAPK信号通路使细胞释放NO,并通过诱导细胞中NF-κB、JNK MAPK和ERK MAPK信号通路活化分泌TNF-α。
| 图表编号 | XD00179312300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.30 |
| 作者 | 余刚、蔡薇、宋田源、姜泽东、倪辉、刘光明 |
| 绘制单位 | 集美大学食品与生物工程学院、厦门市疾病预防控制中心、集美大学食品与生物工程学院、集美大学食品与生物工程学院、福建省食品微生物与酶工程重点实验室、集美大学食品与生物工程学院、福建省食品微生物与酶工程重点实验室、集美大学食品与生物工程学院、厦门市海洋功能食品重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式