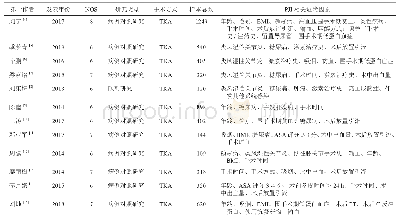
《表1.DECs的基本特征(根据文献[1–2,11–12,14–18]整理)》
![《表1.DECs的基本特征(根据文献[1–2,11–12,14–18]整理)》](http://bookimg.mtoou.info/tubiao/gif/WSXB202008002_00900.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《不同致泻性大肠杆菌感染调控细胞信号通路的研究进展》
以上五种细菌(EPEC、EHEC、ETEC、EAEC、DAEC)都能附着于宿主细胞的表面,在细胞水平或多或少引起p65磷酸化,但磷酸化的程度较低。与胞外细菌相比,可侵入胞内的EIEC诱导的p65磷酸化程度较强,超过TNF-α单独诱导的p65磷酸化水平。在EIEC与TNF-α的共同刺激下,HT-29细胞p65的磷酸化程度增加[11]。EIEC没有鞭毛,不能通过TLR5识别,而是通过胞内NLR激活NF-κB,与TNF-α引起的p65磷酸化无关[18]。EIEC的效应蛋白IpgB2、OspB与NOD1/2结合,激活NF-κB和MAPK(表2)。EIEC的抑制效应主要由OspI、OspF、OspG等协同发挥作用。泛素(Ubiquitin,Ub)是一种广泛存在于真核生物体内的多肽,可在激活酶(E1)、结合酶(E2)和连接酶(E3)的作用下对底物进行修饰。由志贺氏菌和EIEC编码的效应蛋白作用于NF-κB通路中的各个环节,如OspI抑制了K63-Ub(泛素分子连接在前一泛素分子第63位赖氨酸残基)的形成,IpaH1.4和IpaH2.5影响TNF、IL-1β和PAMP RSCs中M1-Ub(泛素分子连接在前一泛素分子第1位甲硫氨酸残基)的形成,NleE同源物OspZ也通过49GITR52基序与TAB3结合,并通过TAB3的修饰阻断TAB-TAK复合物向K63-Ub的募集,减少了IL-8的转录[19,26](图1)。
| 图表编号 | XD00156700700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.04 |
| 作者 | 连思琪、吴云平、杨敏卉、夏芃芃、朱国强 |
| 绘制单位 | 扬州大学兽医学院比较医学研究院、江苏省动物重要疫病与人兽共患病防控协同创新中心、扬州大学兽医学院比较医学研究院、江苏省动物重要疫病与人兽共患病防控协同创新中心、扬州大学兽医学院比较医学研究院、江苏省动物重要疫病与人兽共患病防控协同创新中心、扬州大学兽医学院比较医学研究院、江苏省动物重要疫病与人兽共患病防控协同创新中心、扬州大学兽医学院比较医学研究院、江苏省动物重要疫病与人兽共患病防控协同创新中心 |
| 更多格式 | 高清、无水印(增值服务) |

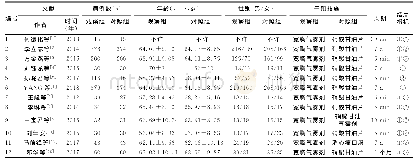
![表2 我国不同地区煤层气地质特征及勘探开发技术适应性对比(据文献[11-16,25-35]整理)](http://bookimg.mtoou.info/tubiao/gif/MTXB202101007_03000.gif)