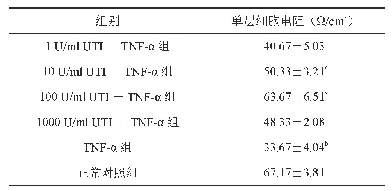
《表1 实验前后细胞跨膜电阻的变化》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《Caco-2细胞模型不同取样方式对药物表观渗透系数的影响》
将Caco-2细胞培养于细胞瓶中,并置5%CO2、37±1℃培养箱中,细胞所需营养物质为15%DMEM高糖培养液(含有15%胎牛血清、1%非必需氨基酸、1%100 U·m L-1青霉素G以及100μg·m L-1链霉素)。待细胞生长至对数期后,采用灭菌后的PBS缓冲液清洗,并加入0.25%Trypsin-EDTA消化液消化细胞,于1.2×103r·min-1离心3 min,弃去上清液,并重新添加培养基吹打细胞,待细胞分散均匀后,对细胞进行台盼蓝染色并计数,以每毫升1×105个的细胞密度接种于Transwell 12孔板,其中,AP侧为0.5 m L相应密度的细胞悬液,BL侧为1.5 m L的DMEM高糖培养液,置恒温培养箱中,连续培养21 d。接种后的前一周,隔天换液,一周后,每天换液,并测量扩膜电阻值(TEER值),以跨膜电阻值来判定Caco-2细胞层的完整性,文献显示:当Transwell小室内的跨膜电阻值≥220Ω·cm2,可用于药物渗透性转运的模型[5]。记录实验前后的细胞跨膜电阻值,以判断实验结束后,细胞膜是否完整。实验前后的细胞跨膜电阻值见表1。Caco-2细胞单层细胞的TEER值大于300Ω·cm2,据文献中报道,当TEER值≥220Ω·cm2时,表明单层细胞的紧密型和完整性良好,建立的Caco-2细胞模型满足要求,可以用于Caco-2细胞转运实验。在实验前后,细胞跨膜电阻值虽略降低,但仍达到了单层细胞TEER值大于300Ω·cm2的要求,表明在实验过程中,细胞单层膜未被破坏。
| 图表编号 | XD00149144300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.01 |
| 作者 | 王颖、朱淑珍、伍邦青、邓黎、贺英菊 |
| 绘制单位 | 四川大学华西药学院、四川大学华西药学院、四川大学华西药学院、四川大学华西药学院、四川大学华西药学院 |
| 更多格式 | 高清、无水印(增值服务) |