《表1 18F-PBR06注射液的质量控制标准及检验方法》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《神经炎症显像剂~(18)F-PBR06的自动化制备》
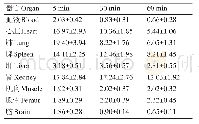
注:*低于HPLC检测方法的定量限0.08μgm L-1
18F-PBR06注射液的质量控制标准参考中国药典2015年版相关规定及已收录品种制定[11],检验内容表1。合成结束后,首先用注射用水冲洗生产中使用的0.22μm无菌滤膜,然后通过起泡点检测考察滤膜完整性,然后从产品瓶中抽取2 m L制剂溶液用于质量控制分析:将1 mL质控样品加入到无菌瓶中,待衰变后进行无菌检测。将剩余1 mL样品加入到无菌试管中,用于其他项目质控分析:首先在明亮的灯光下于铅玻璃后目视进行外观检查;移取20μL样品用细菌内毒素检测用水稀释50倍,用于进行内毒检测;移取500μL样品,通过活度计测定放射性浓度和半衰期;移取100μL样品,用色谱级水稀释50倍,进行气相色谱分析检测残留溶剂(色谱条件为:柱温200℃,进样口温度跟随柱温,检测器温度240℃,氢气流速30 m L?min-1,进样量1μL);取100μL样品,通过pH计测定pH值;取20μL样品进行HPLC分析(流动相为:含氟化钾1 g?L-1的乙腈/pH 6.7磷酸盐缓冲溶液=70/30,流速1 m L?min-1,检测波长230 nm),进行放射化学鉴别、放射化学纯度、化学杂质和18F-PBR06含量测定;取2μL样品,通过比色法进行K222限量检查。
| 图表编号 | XD00148512000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.15 |
| 作者 | 乔洪文、李则、陈树安、梁志刚、卢洁 |
| 绘制单位 | 首都医科大学宣武医院核医学科、首都医科大学宣武医院核医学科、首都医科大学宣武医院核医学科、首都医科大学宣武医院核医学科、首都医科大学宣武医院信息中心、首都医科大学宣武医院核医学科、首都医科大学宣武医院放射科 |
| 更多格式 | 高清、无水印(增值服务) |