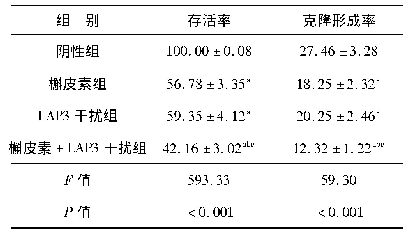
《表2 各组细胞克隆形成率(n=3)》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《瓜蒂水提物和醇提物对食管癌TE-1、EC-1细胞的增殖、迁移、克隆形成的影响及机制研究》
注:与TE-1/EC-1空白组比较,**P<0.01;与TE-1/EC-1瓜蒂水提物组比较,#P<0.05
制备TE-1、EC-1单细胞悬液,调整细胞浓度为8×103个/mL。将细胞分为TE-1空白组、TE-1瓜蒂水提物组、TE-1瓜蒂醇提物组、EC-1空白组、EC-1瓜蒂水提物组、EC-1瓜蒂醇提物组,每组3个复孔,进行软琼脂克隆形成试验。分别配制0.6%、1.2%的低熔点琼脂糖溶液,80℃水浴完全溶解后高压灭菌,备用;将1.2%低熔点琼脂溶液与2×RMPI 1640含血清培养基以1∶1(V/V)制成0.6%底层琼脂液,再以0.8 mL/孔铺满24孔板(TE-1、EC-1细胞各1个),室温静置凝固;将0.6%低熔点琼脂液与2×RMPI 1640含血清培养基以1∶1(V/V)制成0.3%的上层琼脂液,每孔加0.8 mL上层琼脂液和100μL TE-1细胞或EC-1单细胞悬液。各加药组分别加入含有瓜蒂水提物或醇提物IC50浓度药液10μL(空白组不加),室温静置凝固,再于37℃、5%CO2的细胞培养箱中培养2周。显微镜下肉眼观察细胞克隆球并计数,计算细胞克隆数和克隆形成率,细胞克隆形成率=平均细胞克隆数/每孔接种细胞数×100%[8]。各组细胞的软琼脂克隆球观察结果见图4,细胞克隆形成率见表2。
| 图表编号 | XD00143195900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.15 |
| 作者 | 赵雯宇、司富春 |
| 绘制单位 | 河南中医药大学河南省中医方证信号传导重点实验室、河南省中医方证信号传导国际联合实验室、河南中医药大学河南省中医方证信号传导重点实验室、河南省中医方证信号传导国际联合实验室 |
| 更多格式 | 高清、无水印(增值服务) |