《表3 不同来源ω-转氨酶催化性能比较》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《构建辅酶自循环系统全细胞催化合成S-2-氨基-1-苯基乙醇》
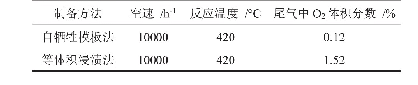
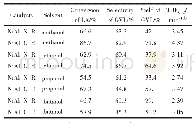
(1)温度和pH对PAKω-TA酶活力及稳定性的影响:纯化后PAKω-TA酶液用于酶学特性研究.如图3a所示,相对酶活力随着pH的增加而提高,直至在pH 8.0时达到最大值.37℃温育1 h后,酶在pH 7.0-8.0之间稳定,并保持80%以上的相对活性.根据之前的研究表明,已报告的大多数ω-转氨酶的最适pH值高于pH 9.0(表3)[9,26-27].然而,该碱性条件不适合醇脱氢酶和谷氨酸脱氢酶,因为它们的最佳pH值在7.0-8.5之间.因此,本研究中使用的PAKω-TA对于多酶级联催化反应表现出很好的兼容性.
| 图表编号 | XD00142346400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.25 |
| 作者 | 赵有玺、刘松、张显、徐美娟、杨套伟、饶志明 |
| 绘制单位 | 北京联合大学生物化学工程学院、江南大学生物工程学院工业生物技术教育部重点实验室、江南大学生物工程学院工业生物技术教育部重点实验室、江南大学生物工程学院工业生物技术教育部重点实验室、江南大学生物工程学院工业生物技术教育部重点实验室、江南大学生物工程学院工业生物技术教育部重点实验室、江南大学生物工程学院工业生物技术教育部重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |