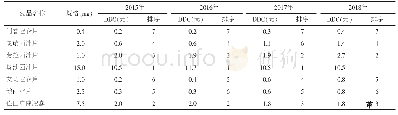
《表3 2015-2018年我国发布药品说明书修订情况》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《上市许可持有人制度下药品生产企业不良反应监测模式探讨》
报告收集是基础,如何从收集到的个例报告中发现风险信号,并对相关风险进行评估、控制是开展药品不良反应监测的目的。为了切实提高生产企业对上市后药品风险的防控能力,国家中心自2009年起开始向生产企业反馈该企业品种在全国发生的ADR报告,并且由最初的一年反馈一次,逐渐增加到每季度反馈一次,直至当前每一个月反馈一次。为不断增强药品不良反应分析评价能力,国家中心采取日监测、周汇总、季度分析等工作机制对监测数据进行分析评价,深入挖掘药品风险信号,并采取修订药品说明书、暂停生产销售等风险管理措施。据国家食品药品监督管理局网站显示[12],2015年1月至2018年11月,共发布药品说明书修订公告89期(见表3),且70%以上公告明确表示其修订基于药品不良反应监测评估结果。但从对生产企业的ADR监测情况以及文献报道[13-15]来看,我国多数生产企业存在监测人员数量有限,专业技术能力不足,信息利用度不高,风险控制措施实施不到位等情况。如沈梦秋等[7]对江苏省辖区内92家药品生产企业进行的ADR检查情况分析显示,在定期安全性更新报告方面共有缺陷55项,65.45%的缺陷项集中在企业未对严重病例进行逐例分析,未对反馈的数据进行深入分析和评价等;在评价与控制方面共有缺陷62项,80.64%的缺陷项集中在企业未主动对监测数据进行深入分析、信号提取、风险识别、调查确认、主动开展安全性研究等。这与我省生产企业ADR检查情况一致。此外,与国外企业相比,我国药品生产企业在风险沟通方面存在严重不足,以吗替麦考酚酯制剂为例,其进口产品在获得批准证明文件后主动进行了10次左右的说明书内容修订,而国产产品绝大多数企业未进行任何修订,部分企业仅有1~2次修订[16]。
| 图表编号 | XD00129282700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.05 |
| 作者 | 王长之、陈晓博、刘曦朦、刘超 |
| 绘制单位 | 河南省食品药品评价中心、河南省食品药品评价中心、河南省食品药品评价中心、河南省食品药品评价中心 |
| 更多格式 | 高清、无水印(增值服务) |