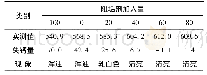
《表5 共存离子对Mg/Fe-LDH吸附水中磷酸盐的影响/mg·g-1》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《镁铁层状双金属氢氧化物对磷酸盐的吸附作用及对内源磷释放的控制效果及机制》
天然水体中往往共存有Na+、K+、Ca2+、Mg2+等阳离子和Cl-、SO42-、HCO3-等阴离子.因此,了解这些阴阳离子的存在对Mg/Fe-LDH吸附水中磷酸盐的影响,对于应用其控制水体内源磷释放是非常必要的.表5为共存离子对Mg/Fe-LDH吸附水中磷酸盐的影响.从中可见,共存2 mmol·L-1NaCl和KCl对Mg/Fe-LDH吸附水中磷酸盐的影响很小.这说明,溶液共存一定数量的Cl-、Na+和K+对Mg/Fe-LDH吸附水中磷酸盐的影响可以忽略不计.当共存2 mmol·L-1Na2SO4和NaHCO3时,Mg/Fe-LDH对水中磷酸盐的吸附容量与对照组相比分别下降了26.7%和9.50%.这说明溶液共存一定数量的SO42-和HCO3-会抑制Mg/Fe-LDH对水中磷酸盐的吸附.当共存2 mmol·L-1的CaCl2和MgCl2时,Mg/FeLDH对水中磷酸盐的单位吸附量分别增加了77.3%和17.0%.这显示了溶液共存一定数量的Ca2+和Mg2+会促进Mg/Fe-LDH对水中磷酸盐的吸附,且共存Ca2+的促进作用明显强于Mg2+.磷酸盐被吸附到金属氧化物表面上通常会形成两类配合物,即通过配位体交换作用形成的内层配合物和通过静电吸引作用形成的外层配合物[44].如果吸附机制以外层配合物形成为主的话,那么金属氧化物对水中磷酸盐的吸附能力通常会随着共存电解质浓度的增加而降低,而如果吸附机制以内层配合物形成为主的话,那么金属氧化物对水中磷酸盐的吸附通常不会受到共存电解质的抑制[44].共存一定数量的Cl-对Mg/Fe-LDH吸附水中磷酸盐的影响很小(表5),这说明配位体交换和内层配合物形成是Mg/FeLDH吸附水中磷酸盐的重要机制.共存一定数量的SO42-和HCO3-会对吸附产生一定的抑制作用(表5),这说明除了配位体交换作用外,静电吸引作用也是Mg/Fe-LDH吸附水中磷酸盐的重要机制.Ca2+和Mg2+的促进作用可以解释为:当溶液pH值为7时,Ca2+和Mg2+会与水中的磷酸盐(HPO42-)形成离子对CaHPO40和MgHPO40;与H2PO4-和HPO42-相比,CaHPO40和MgHPO40更容易被吸附到铁氧化物表面上形成三元配合物—Fe-O(PO)(O2HCa)+和—Fe-O(PO)(O2HMg)+,导致存在Ca2+/Mg2+条件下Mg/Fe-LDH对水中磷酸盐吸附量高于不存在Ca2+/Mg2+条件下的吸附量[45,46].
| 图表编号 | XD00118271300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.15 |
| 作者 | 吴俊麟、林建伟、詹艳慧、程永前、柏晓云、辛慧敏、常明玥 |
| 绘制单位 | 上海海洋大学海洋生态与环境学院、上海海洋大学海洋生态与环境学院、上海海洋大学海洋生态与环境学院、中国环境科学研究院、上海海洋大学海洋生态与环境学院、上海海洋大学海洋生态与环境学院、上海海洋大学海洋生态与环境学院 |
| 更多格式 | 高清、无水印(增值服务) |