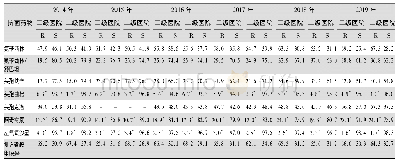
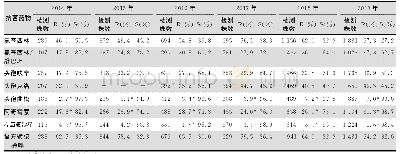
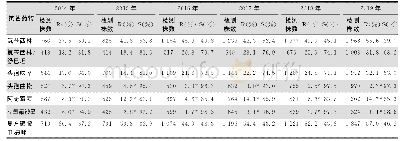
《表4 BLNAR流感嗜血杆菌检测以及药敏结果报告情况》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《评估新型奈瑟嗜血杆菌药敏试剂盒测试流感嗜血杆菌药敏结果》
注:根据CLSI M100-S29指南对流感嗜血杆菌药敏结果的解释,当BLNAR菌株检出时,AMC、SAM、CXM、TZP等抗菌药物在体外试验敏感的条件下也因该报告为耐药。S:敏感;I:中介;R:耐药;S→R/I→R:原根据MIC值判定为敏感/中介但由于被判定为BLNAR菌株而报告为耐药
一般来说,Kappa≥0.75即可认为2种方法一致性良好,若Kappa<0.4则认为二者一致性不理想。同时根据ISO20776-2指南要求,评估MIC药敏设备时,CA和EA应当大于90%,MD和VMD应当小于3%。当耐药菌株数明显不足时,应考虑适当放宽标准。从药敏试验结果比对分析来看,对药敏卡中除AMP、MEM以外的药物,NH-AST试剂卡与对照方法的检测结果间有良好的一致性(Kappa≥0.75,P>0.05);MEM药敏评估结果的Kappa值仅为0.4925,一致性相对其他抗菌药物较差,但通过分析菌株药敏结果分布可以看出,由于对MEM敏感的菌株数达到99%(100/101),且2种方法检测得到菌株药敏结果分布差异无统计学意义(P<0.05)。这种明显的菌株分布不均导致当有2株菌株药敏结果出现较大偏差(待测方法R/对照方法S)时,即会导致Kappa值变化,因此结合CA、EA、MD、VMD等评估指标,在目前的药敏结果分布情况下,除了EA略低于90%外,其余指标均符合ISO20776-2指南标准。对于AMP的药敏结果,2种方法间的一致性较好(Kappa=0.9196),但2种方法的药敏结果分布上的差异有统计学意义(P<0.05)(见表2)。NH-AST报告的AMP结果更偏耐药,这也是直接导致该试剂卡报告的BLNAR菌株数量偏高的原因。一共有6株流感嗜血杆菌使用对照方法时报告的AMP药敏结果为中介(MIC=2),而同时NH-AST报告结果为耐药(MICAMP≥4μg/mL)(见表4)。CLSI中关于流感嗜血杆菌药敏结果解释中指出,当罕见的BLNAR菌株出现时,AMC、SAM、CXM、TZP等抗菌药物在体外试验敏感的条件下也应报告为耐药。因此,在此规则下,NH-AST试剂卡检出的7株假阳性BLNAR菌株的相关抗菌药物的报告结果会出现调整(见表4)。在8株AMC结果判读出现较大偏差的菌株中,有6株是BLNAR判读不一致所导致的;2株CXM结果判读出现较大偏差的菌株,有1株为BLNAR;同样在SAM结果判读有较大偏差的6株菌株中有4株由于BLNAR判读不一致导致的,而6株TZP结果判读有较大偏差的菌株均是由于BLNAR判读不一致造成的。因此,NH-AST检测判读的BLNAR菌株报告应给谨慎对待,可以考虑使用其他临床常规药敏试验方法(如K-B纸片扩散法)加以确认[13]。在计算VMD的过程中,纳入研究范围的耐药菌株数不足时很容易出现VMD超过3%的标准,在全部超过标准规定的6种抗菌药物中,出现重大偏差的菌株仅为1~2株,由于耐药菌株不足(少于30株),因此VMD不足以否定待测系统与对照方法中这些药物结果的一致性,而应通过比较Kappa值来评估其一致性。同时,将全部1 818个测试数量进行总体统计分析可以发现,除VMD略高于3%外,CA、EA、MD均达到了ISO20776-2的标准。
| 图表编号 | XD00113726000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.25 |
| 作者 | 李欣欣、肖淑珍、谭希婧、倪语星、韩立中 |
| 绘制单位 | 上海交通大学医学院附属瑞金医院微生物科、上海交通大学医学院附属瑞金医院微生物科、上海交通大学医学院附属瑞金医院微生物科、上海交通大学医学院附属瑞金医院微生物科、上海交通大学医学院附属瑞金医院微生物科 |
| 更多格式 | 高清、无水印(增值服务) |
![表4 2016年—2019年流感嗜血杆菌对常用抗生素耐药情况[例(%)]](http://bookimg.mtoou.info/tubiao/gif/ZJZH202102023_02900.gif)