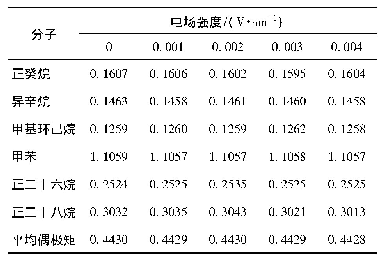
《表3 氢化物的电负性差与分子偶极矩》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《基于培养学生证据意识的高中化学教学探索——以比较CH_4与NH_3稳定性的系统研究为例》
关于分子型氢化物的稳定性有文献指出,非金属与氢的电负性差值越大,组成的氢化物分子的极性就越大,其热稳定性也越大;反之,这个差值越小则越不稳定。表3列出了第二周期常见非金属氢化物的电负性与分子偶极矩的数据,根据文献提出的规律,CH4的稳定性比NH3的要弱,但是从氢化物分解的温度来看,这是相互矛盾的。吴孙福等人解释CH4与NH3利用电负性与热稳定性的矛盾关系时,指出CH4是因为其分子结构高度对称,分子偶极矩为零,从而导致分子比较稳定,但表3的数据显示了分子的偶极矩越大热稳性越强的趋势。
| 图表编号 | XD0099612600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.10 |
| 作者 | 计从斌、余焕焕、林建芬 |
| 绘制单位 | 上饶师范学院化学与环境科学学院、上饶师范学院化学与环境科学学院、上饶师范学院化学与环境科学学院、深圳市宝安区宝安中学(集团) |
| 更多格式 | 高清、无水印(增值服务) |