《表3 质量目标改进及质控方案选择》
注:a:俄罗斯强制认证标准。
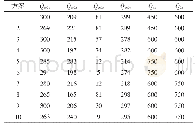
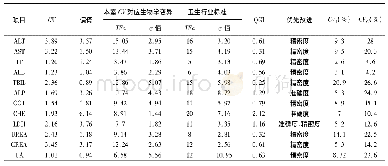
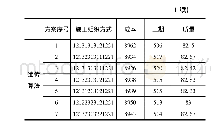
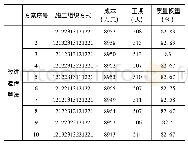
由于不同来源的允许总误差(TEa)不同,故计算所得的σ值也是不同的。目前临床较常用的总误差来源分别有:(1)美国临床实验室改进修正法案(CLIA’88);(2)我国行业标准及卫健委室间质评分析质量目标;(3)Ricos生物学变异数据库;(4)加拿大质量管理计划-实验室服务(QMP-LS);(5)加拿大健康质量管理组织标准(IQMH);(6)澳大利亚皇家病理家学会(RCPA);(7)瑞士医学实验室质量保证委员会(QUALAB);(8)德国医学实验室定量分析质量评估医学委员会(RiliBAK);(9)比利时公共卫生科学研究所(IPH Belgium);(10)俄罗斯强制认证标准(GOST)。一般认为基于生物学变异的质量标准可能更接近临床需求,但其适当性仍存在争议,有人认为采样生物变异的总误差对于一些典型的常规实验的分析质量来说可能太过于严格[11];对于采取室间质评分析质量目标来源的TEa方便统计,但对于有些项目未开展室间质评的尚无评价标准。我们根据不同的σ值选择了不同的质量目标。如表3所示,CA125和tPSA采用最佳水平的生物学变异质量目标,CEA和CA153采用期望水平的生物学变异质量目标,CA199和β-HCG采用美国CLIA’88标准,FER和fPSA采用卫健委临检中心EQA标准,而AFP采用俄罗斯GOST标准。
| 图表编号 | XD0090492200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.15 |
| 作者 | 翟光华、马俭良、郑永生、李美芬 |
| 绘制单位 | 南京医科大学附属苏州医院北区检验科、南京医科大学附属苏州医院北区检验科、南京医科大学附属苏州医院北区检验科、南京医科大学附属苏州医院北区检验科 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式