《表6 疫苗成品加速破坏性考察结果一览表[(37±1)℃]条件下》
![《表6 疫苗成品加速破坏性考察结果一览表[(37±1)℃]条件下》](http://bookimg.mtoou.info/tubiao/gif/GSYY201906031_02600.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《生产场地变更后双价肾综合征出血灭活热疫苗的长期稳定性研究》
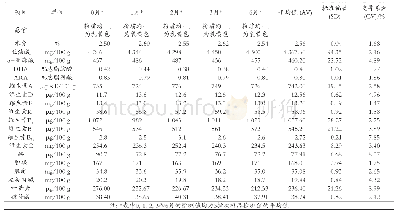
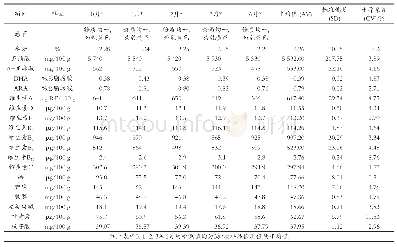
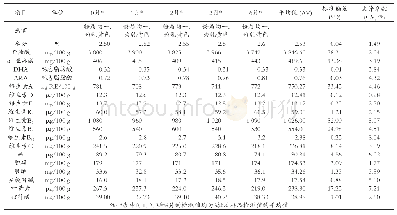
随着疫苗生产企业向规模化、集团化、集约化发展,越来越多的疫苗生产企业进行了改建或扩建。生产场地变更是一类风险较大的变更,可能对产品的安全性、有效性产生影响[4],在整个稳定性考察方案中,单价疫苗原液的定量考察项目是抗原含量、蛋白质含量、牛血清白蛋白残留量和地鼠肾细胞蛋白质残留量,其中抗原含量稳定可以保证疫苗的有效性,牛血清白蛋白和地鼠肾细胞蛋白质是有害物质,含量稳定可以保证疫苗的安全性。公司以近年连续生产的62批单价疫苗原液的抗原含量、牛血清白蛋白含量及地鼠肾细胞蛋白质残留量检测的历史数据计算95%可信区间,依据该结果、企业注册标准及《中国药典》(2010年版)三部[5]的要求确定变更生产场地后的验收标准,抗原含量的验收标准是≥1∶1024,牛血清白蛋白残留量≤15ng/ml,地鼠肾细胞蛋白质残留量为4~12μg/ml,均高于药典标准。从变更后的6批单价疫苗原液的检测结果来看,抗原含量、牛血清白蛋白含量及地鼠肾细胞蛋白质含量均符合本企业的标准。疫苗成品的定量考察关键项目是氢氧化铝含量、硫柳汞含量、游离甲醛含量、效价及抗生素残留量,其中氢氧化铝是疫苗佐剂,硫柳汞是防腐剂,其含量均应尽可能均一;游离甲醛及抗生素均是有残留物质,应尽可能去除;效价是疫苗最重要的指标之一,可以保证疫苗的有效性[6-7]。公司以近年连续生产的24批成品的氢氧化铝含量、硫柳汞含量、游离甲醛含量、效价及抗生素残留量检测的历史数据计算95%可信区间,依据该结果、企业注册标准及《中国药典》(2010年版)三部确定变更生产场地后的验收标准,氢氧化铝含量验收标准是0.30~0.56mg/ml,硫柳汞含量验收标准是44~55μg/ml,游离甲醛含量验收标准是<22μg/ml,抗生素残留量验收标准是0~4ng/剂,均高于药典标准,效价验收标准是≥1∶10,同药典标准。可见,生产场地的变更并未使出血热疫苗的稳定性发生差异。杂质水平比较是质量可比性研究关注的重点,通过对各项杂质成分检测结果的分析,也说明生产过程所产生的杂质在新车间得到了有效的控制。
| 图表编号 | XD0088207700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.15 |
| 作者 | 王伟、张颖、孙宏亮、李春艳 |
| 绘制单位 | 长春生物制品研究所有限责任公司、长春生物制品研究所有限责任公司、长春生物制品研究所有限责任公司、长春生物制品研究所有限责任公司 |
| 更多格式 | 高清、无水印(增值服务) |