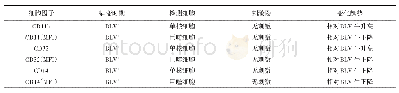
《表1 人体中多因素比较MDSCs与中性粒细胞、单核细胞、肿瘤相关巨噬细胞》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《肿瘤微环境中不同亚型的髓源抑制性细胞及中医药对其调控作用的研究进展》
在人体中,基于主要组织相容性复合物(MHCⅡ)类分子的人类白细胞抗原-DR(HLA-DR)的表达,可以将M-MDSCs从单核细胞中分离出来。此外,将M-MDSCs与肿瘤相关巨噬细胞(TAM)区别出来可通过增加F4/80的相对表达,Ly6C(表达从低到中等),钙结合蛋白S100A9(低表达或不表达)以及干扰素调节因子8(IRF8)的低表达和集落刺激因子(CSF)上的受体CD115表达增加[18]等方法来鉴别分离。而在健康的人体中,G-MDSCs几乎检测不到,并且有的报道甚至将G-MDSCs定义为作为中性粒细胞的一种功能性异质性表型[19]。目前将人G-MDSCs从嗜中性粒细胞中分离的方法除了流式检测不同的表型标记以外,最有效的方法是使用标准聚蔗糖(Ficoll)进行梯度离心,由于两者的细胞密度不同,可将富含低密度组分的G-MDSCs与高密度细胞组分的嗜中性粒细胞分离开来[20]。最近的研究显示,凝集素型氧化LDL受体-1(LOX-1)可在不使用Ficoll梯度离心的情况下区分人嗜中性粒细胞和G-MDSCs,并将LOX-1作为人类G-MDSCs的标志物[21]。此外,还可以通过基因谱,细胞核的形态(G-MDSCs呈环形表观,而中心粒细胞则呈多分叶状表观)的不同来区分二者[22]。但在小鼠模型中,将G-MDSCs与嗜中性粒细胞和单核细胞分离出来更具挑战性,这可能是由于小鼠的疾病模型和人类疾病之间的差异。比如大多数荷瘤小鼠模型都涉及到肿瘤细胞的移植,模型小鼠在短时间内接受大剂量的肿瘤细胞,细胞堆积会产生炎症并加速肿瘤的进展,从而导致MDSCs直接取代组织与循环系统的中性粒细胞和单核细胞出现大量的累积,而在人类肿瘤的发展过程中却并非如此[23]。此外,在小鼠模型中,利用表型差异在同一小鼠中鉴别嗜中性粒细胞和G-MDSCs是困难的,虽提出了几种不同的标记,但是迄今为止都没能明确将两者鉴别开来,在人体、小鼠、大鼠中受多种因素影响的不同细胞间的对比。虽然不同的表型标记是定义MDSCs第一个步骤,但是不能将它作为区别G-MDSCs与中性粒细胞,以及M-MDSCs与单核细胞的唯一标准;eMDSCs,MDSCs前体细胞;N/A,尚未清楚;大鼠情况研究甚少,见表1~3。
| 图表编号 | XD0086266800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.07.20 |
| 作者 | 胥孜杭、张飞、朱杨壮壮、仲海荣、朱诗国、王莉新、韦璐瑶、陈晓、邹纯朴 |
| 绘制单位 | 上海中医药大学基础医学院经方理论应用研究中心、上海交通大学医学院附属新华医院、上海中医药大学基础医学院经方理论应用研究中心、上海中医药大学基础医学院经方理论应用研究中心、上海中医药大学基础医学院经方理论应用研究中心、上海中医药大学基础医学院经方理论应用研究中心、上海中医药大学基础医学院经方理论应用研究中心、上海中医药大学基础医学院经方理论应用研究中心、上海中医药大学基础医学院经方理论应用研究中心 |
| 更多格式 | 高清、无水印(增值服务) |