《表1 HIF-1α和MVD在IBC-NST和正常乳腺组织中的表达差异》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《缺氧诱导因子-1α与非特殊型浸润性乳腺癌分子分型及血管生成的关系分析》
Eli Vision免疫组化检测二步法主要步骤如下:乳腺癌组织经4%中性甲醛固定、石蜡包埋组织以3~4μm厚度切片并贴于防脱玻片,经脱蜡、水化及抗原修复后,以3%H2O2阻断内源性过氧化物酶,滴加一抗,室温孵育60 min,滴加聚合物增强剂,室温孵育20 min,滴加酶标抗鼠/兔聚合物,室温孵育30 min,再经DAB显色,苏木精衬染,脱水干燥及封片后置于普通光学显微镜下观察。另检测正常乳腺组织HIF-1α、CD34的免疫组化表达情况作为对照。各项指标检测过程中均以已知阳性片作为阳性对照,以PBS代替一抗作为阴性对照。HIF-1α结果判定采用半定量法:将定位于IBC-NST细胞核的染色按深浅评分,无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;再对整张切片中着色IBC-NST细胞占IBC-NST细胞总数的比例评分,着色细胞<5%为0分,着色细胞≥5%且<10%为1分,着色细胞≥10%且<50%为2分,着色细胞≥50%为3分;两项得分乘积≥4为HIF-1α阳性表达;正常对照组乳腺细胞核HIF-1α表达情况参照此法判读。IBC-NST组织HER2免疫组化结果判读根据2018年ASCO/CAP发布的检测指南[5],将3+(10%以上浸润性癌细胞呈强且完整的细胞膜染色)定义为HER2阳性;2+(10%以上浸润性癌细胞呈弱到中等强度的完整细胞膜染色)为结果不确定,需进一步荧光原位杂交法(Fluorescence in situ hybridization,FISH)检测HER2基因扩增情况后再判定阳性或阴性;1+及0则定义为HER2阴性。ER和PR表达结果的判读根据2010年ASCO/CAP发布的乳腺癌ER、PR免疫组化检测指南[6],评估整张切片中ER或PR阳性的IBC-NST细胞数占IBC-NST细胞总数的百分比,当≥1%的IBC-NST细胞核呈现不同程度的ER或PR着色时,即为ER或PR阳性。Ki67结果判读方法参照2011年国际乳腺癌Ki67工作组共识[7]:选取切片中IBC-NST细胞核Ki67表达率高的热点区,于高倍视野下评估Ki67阳性的IBC-NST细胞数占IBC-NST细胞总数的百分比,观察3个以上高倍视野(计数500个以上IBC-NST细胞),取平均值作为Ki67表达指数。CD34结果判读参照Weidner标准[8]:IBC-NST组织内CD34细胞浆着色的单个血管内皮细胞或细胞簇,不论是否形成管腔,均代表1个微血管,但管径大于8个红细胞直径的血管不作为计数,选择5个富于微血管的热点区,在200倍视野下计数每个视野中的微血管数量,取平均值作为微血管密度(Microvessel density,MVD);正常对照组MVD参照此法判读。
| 图表编号 | XD0085181100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.12 |
| 作者 | 黄玉钿、郑曦、吴钦穗、薛玉钦、吴进 |
| 绘制单位 | 福建医科大学附属福州市第一医院病理科、福建医科大学附属福州市第一医院病理科、福建医科大学附属福州市第一医院病理科、福建医科大学附属福州市第一医院病理科、福建医科大学附属福州市第一医院病理科 |
| 更多格式 | 高清、无水印(增值服务) |
![表1 LGR5、HIF-1α在胃癌和癌旁组织中的表达情况[例(%)]](http://bookimg.mtoou.info/tubiao/gif/LIYX202004015_03600.gif)
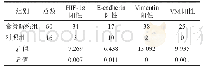

![表1 HIF-1α、Bcl-2、β-catenin在不同子宫内膜组织中的表达情况[例(%)]](http://bookimg.mtoou.info/tubiao/gif/FKLC202005011_05900.gif)

