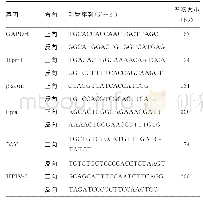
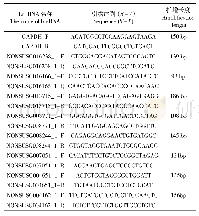
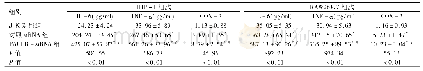
《表1 人腺病毒感染MRC-5细胞后炎症细胞因子的表达差异基因筛选》
注:筛选条件为fold change≤0.5或者fold change≥2.0。
病毒介导的组织损伤有三个机制参与:(1)由于病毒的复制或者病毒成分所产生的细胞毒性;(2)细胞炎症浸润产生的毒性;(3)病毒刺激产生的细胞因子效应[8]。人体内人腺病毒活跃感染诱导产生的细胞因子似乎是病情严重程度的标志。另外,有研究认为,人腺病毒型别特异性感染可能是细胞因子诱导的差异和对特定感染病毒类型免疫反应的启动的结果,并推测肺炎诱导的型别特异性可能与肺细胞中型别特异性细胞因子的诱导有关[9]。为了验证这一假设,本研究将人肺成纤维细胞(MRC‐5细胞)分别感染不同型别及不同处理方式的人腺病毒进行炎症细胞因子的感染特性比较,其中,HAdV‐55感染MRC‐5细胞后(图3),随着时间的增加,IL‐1α和IL‐1β的表达差异趋势上调。有研究人员从转录组水平研究发现IL‐1α的mRNA与HAdV‐55感染的严重程度呈正相关[10],与本研究结果相符,这一定程度上表明IL‐1α可能与HAdV‐55感染的严重程度有关。另外,根据表达差异基因筛选结果(表1),人腺病毒感染MRC‐5细胞后两个时间点之间表达差异的炎症细胞因子主要在IL‐6和IL‐8。相关研究表明,IL‐6和IL‐8会导致人腺病毒疾病的严重程度[11,12]。Higginbotham J N等[13]使用低剂量HAdV‐5(10PFU/细胞)感染PBMC细胞,可引起IL‐6和IL‐8表达上调,并且在24h内,IL‐6上调快速,这些结果和本研究用低剂量HAdV‐5感染MRC‐5细胞的结果相符,但是本研究不能排除是否存在血清的影响。有研究表明,用HAdV‐3和HAdV‐7感染人支气管上皮细胞BEAS‐2B,当MOI=1时,IL‐6和IL‐8在两种人腺病毒中的表达无差异;当MOI=100时,IL‐6和IL‐8表达增加[14]。还有研究人员将人胚肺成纤维细胞(GM5387细胞)和A549细胞分别感染活的HAdV‐5和HAdV‐7,以对IL‐8蛋白的产生无影响的辐照灭活病毒为对照,低剂量(0.001~0.1MOI)的HAdV‐5和HAdV‐7感染细胞后IL‐8的表达并没有显著差异[9],与本研究结果相似;该研究也表明病毒经梯度离心高度纯化,纯化后的病毒库中未检测到细胞因子IL‐6和IL‐8,这也和我们的实验结果相似。我们实验用到的嵌合重组人腺病毒和灭活的人腺病毒均经过氯化铯梯度离心纯化,它们感染MRC‐5细胞后IL‐6和IL‐8表达水平均较低,这表明腺病毒感染MRC‐5细胞引起的炎症细胞因子的效应是由病毒感染细胞而不是污染的细胞因子造成的。本实验局限性在于没有进行剂量依赖研究以及样本量小。但是,这些文献及本研究结果都在一定程度上提示,IL‐6和IL‐8的表达可以作为人腺病毒感染MRC‐5细胞的研究方向,IL‐6和IL‐8信号的阻断是人腺病毒诱导炎症的潜在治疗或者治疗靶点。
| 图表编号 | XD0083680500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.01 |
| 作者 | 陈诗颖、樊晔、张玲、田新贵、周荣 |
| 绘制单位 | 广州医科大学附属第一医院呼吸疾病国家重点实验室广州医科大学、广州医科大学附属第一医院呼吸疾病国家重点实验室广州医科大学、广州医科大学附属第一医院呼吸疾病国家重点实验室广州医科大学、广州医科大学附属第一医院呼吸疾病国家重点实验室广州医科大学、广州医科大学附属第一医院呼吸疾病国家重点实验室广州医科大学 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式