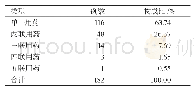
《表1 PRODIGE 24-ACCORD研究因严重不良反应终止规则》
该研究是一种毒性更大的联合治疗方案对比常规治疗在胰腺癌辅助治疗中的尝试,因此对于药物不良反应的监测非常关键。研究过程中是否需要调整剂量?万一出现了严重的不良反应是否该继续试验?该研究对30例患者先进行2个周期的治疗(伊立替康初始剂量采用180 mg/m2),如果3~4级腹泻发生率不超过5%,可以维持180 mg/m2,否则需要降低剂量至150 mg/m2。而对于严重不良反应的监测,虽然多阶段设计和成组序贯设计已被广泛用于各类试验确定终止原则,但是都依赖于入组固定数量患者之后进行的期中分析。由于严重不良反应可能发生在早期阶段,在入组固定数量患者后再进行期中分析在伦理上实际是存在问题的[15]。因此需要进行连续监测,包括了α消耗法、Pocock法和O’Brien-Fleming法二项式概率界值法[16]。本研究在终止规则参数取α=10%,r=4。如果出现了2例因不良反应导致的死亡,并且出现在前9例入组的患者中,那么应立即终止试验,以此类推(表1)。
| 图表编号 | XD0082257000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.05.30 |
| 作者 | 周昌明、高鹤丽、石燕 |
| 绘制单位 | 中国人民解放军总医院肿瘤内科 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式

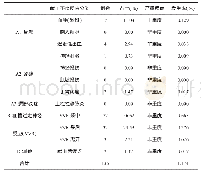
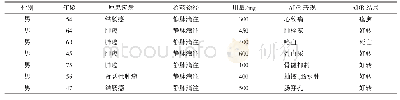
![表1 不同头孢菌素类药物不良反应及严重不良反应发生率[例(%)]](http://bookimg.mtoou.info/tubiao/gif/PLHY202003042_01400.gif)
