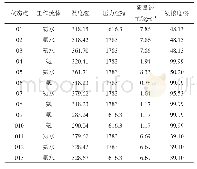
《表3 标准状态下的热力学量》
从热力学角度研究一个反应,只需考虑其起始和最终状态,不考虑中间变化过程。表3为各反应在标准状态1200 K下的标准反应焓变ΔHθ和标准吉布斯自由能变ΔGθ。由表可知,初反应路径中,路径1的ΔHθ<0,表明该反应为放热反应,路径2和3的ΔHθ>0,为吸热反应[19]。路径2的ΔHθ大于路径3,反应时吸收的热量多,与多键断裂有关。反应路径1,是物质热解的初反应阶段,由两个丙氨酸经脱水缩合形成丙-丙二肽,而DKP裂解时ΔHθ>0,是吸热反应,其反应变化过程与反应路径2和3相似。相比之下,次反应的焓变最大,且各反应路径的焓变随温度变化不大。根据ΔHθ的大小,各反应发生顺序为路径1>路径2>路径3。
| 图表编号 | XD0064676600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.01 |
| 作者 | 刘亮、蔡宜捷、田红、夏辉、曹亚 |
| 绘制单位 | 长沙理工大学能源与动力工程学院、长沙理工大学能源与动力工程学院、长沙理工大学能源与动力工程学院、长沙理工大学能源与动力工程学院、长沙理工大学能源与动力工程学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式