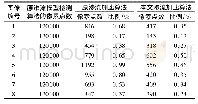
《表2 加速审评程序的时间表Tab 2 Timetable for the accelerated assessment proce-dure》
递交加速审评申请时,申请人应将相关资料(按EMA提供的固定文件模板填写)发送到电子邮箱[email protected]。资料内容包括:1) 递交前申请表(在申请范围项目下选择“加速审评”);2) 加速审评的理由;3) 企业GMP和GCP的信息,用于EMA确认是否需要进行许可前检查[7]。收到加速审评申请后,报告起草人将起草一份简报,其中包含关于加速审评的建议。CHMP将综合考虑申请人递交的申请、报告起草人的建议和其他CHMP成员的意见,以决定是否接受申请;如有需要,CHMP可要求申请人就加速审评申请的相关问题作出解释。CHMP的结论将会传达给申请人,并在CHMP会议摘要和会议记录中公开;接受或拒绝加速审评的理由,亦会在CHMP评估报告中进行阐述。如果加速审评被批准,CHMP将按照加速审评程序的时间表来审评相关药物[8],详见表2(注:此时间表于2016年9月开始使用;2017-2021年加速审评的工作时间表已发布在EMA官方网站上)。
| 图表编号 | XD0047827100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.28 |
| 作者 | 李轩、杨庆、周斌 |
| 绘制单位 | 中国医药工业研究总院、中国医药工业信息中心、中国医药工业研究总院、中国医药工业信息中心、中国医药工业研究总院、中国医药工业信息中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式