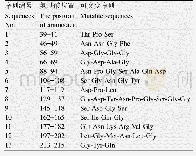
《表2.Bgl3A序列N-糖基化位点预测结果》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《毕赤酵母表达的嗜热蓝状菌β-葡萄糖苷酶N-糖基化修饰的作用与功能》
如图1-A所示,纯化后的各β-葡萄糖苷酶突变体在约75 kDa处出现蛋白条带,并且β-葡萄糖苷酶由于潜在N-糖基化位点不同,使突变体蛋白条带存在差异。其中T44A和S299A突变体的蛋白条带与野生型Bgl3A相似,而S228A蛋白条带在蛋白浓度方面发生明显变化,浓度远小于T44A、S299A和野生型Bgl3A。对T44A、S299A和Bgl3A的酶液进行不同程度的稀释,同时对S228A酶液进行浓缩。然后用Endo H对各突变体进行处理,如图1-B所示,各突变体大小基本一致,处理后的蛋白的分子量均在70 kDa左右。
| 图表编号 | XD0043795600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.04 |
| 作者 | 李新新、柏映国、华晨、马锐、石鹏君、罗会颖、姚斌 |
| 绘制单位 | 中国农业科学院饲料研究所、中国农业科学院饲料研究所、中国农业科学院饲料研究所、中国农业科学院饲料研究所、中国农业科学院饲料研究所、中国农业科学院饲料研究所、中国农业科学院饲料研究所 |
| 更多格式 | 高清、无水印(增值服务) |