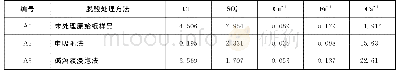
《表2 阴离子供体酸p Ka》
根据共轭酸碱理论,酸的酸性越弱,其共轭碱的碱性越强。因此根据酸碱作用理论,当阴离子供体酸的酸性弱于H2SO3(p Ka1=1.81),即其p Ka值越大于1.81时,形成离子液体的阴离子碱性就比亚硫酸氢根越大,其对SO2吸收能力就越强[38]。实验选择的阴离子供体酸p Ka值见表2。其中[tmtz][Ac]和[tmtz][For]吸收SO2产生液固相变,其吸收性能见图4。[tmtz][Ac]和[tmtz][For]的SO2吸收量明显大于[tmtz][AcCl2]和[tmtz][AcF3],这也说明离子液体的阴离子供体酸的酸性弱于H2SO3时,其吸收SO2的能力远高于阴离子供体酸的酸性强于H2SO3的离子液体,且SO2吸收量[tmtz][Ac]>[tmtz][For],这是因为乙酸根碱性(p Ka=4.79)强于甲酸根碱性(p Ka=3.74);不同的是,[tmtz][AcCl2]仅1.5mol SO2/mol ILs的吸收量,比[tmtz][AcF3]还小,这是由于尽管二氯乙酸根碱性(p Ka=1.37)强于三氟乙酸根(p Ka=0.05),但它们的碱性均不足以脱除亚硫酸分子中的质子(p Ka1=1.81),因此这两种离子液体主要是通过物理作用吸收SO2。而[tmtz][AcF3]因F的强吸电子作用极性比[tmtz][AcCl2]更大,根据相似相溶原理,SO2在[tmtz][AcF3]中溶解度更大;此外,因F电负性很大,与F相连的C带有部分正电荷,整个—CF3作为质子供体[39-40]与SO2中S-O键的O[17]可能形成非常规蓝移氢键[40],这也可能是导致SO2在[tmtz][AcF3]中溶解度更大的原因。
| 图表编号 | XD002540400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.12.05 |
| 作者 | 谢旭豪、陈玲、许胜超、赵文波 |
| 绘制单位 | 昆明理工大学化学工程学院、昆明理工大学化学工程学院、昆明理工大学化学工程学院、昆明理工大学化学工程学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式