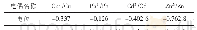《表4 电极反应的标准电位》
各试样在不同溶液中的极化曲线如图2所示。由于参比电极内充液和盐桥内饱和KClO3溶液会影响高纯水体系,所以试验结果仅具有趋势分析性。可见,相对于高纯水,处于Cl-浓度为100μg/L水溶液中的试样,两种不锈钢的极化曲线基本呈现向右下方偏移,当溶液中再加入60μg/L的Cu2+后,曲线偏移更加明显。极化曲线向下偏移表明工作电极的自腐蚀电位负向移动,腐蚀倾向增大,而右移则说明电极发生溶解时反应电流较大,反应速度较快。不锈钢的这种现象可以用电极动力学理论解释。理想状态下,采用标准氢电极测得的Fe和Cu单质在溶液中主要电极反应的标准电极电位如表4所示[9]。Cu变为Cu2+的标准电极电位远正于Fe变为Fe2+的,所以当溶液中同时存在Fe单质和Cu2+时,Cu/Cu2+的反应将作为氧化剂,Fe/Fe2+的反应则作为还原剂,在两者较高的电位差驱动下,发生原电池反应,最终会导致Fe元素的腐蚀溶解。
| 图表编号 | XD0023821500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2018.06.28 |
| 作者 | 朱琦妮、张明、陈文、余建飞、詹约章 |
| 绘制单位 | 国网湖北省电力公司电力科学研究院、国网湖北省电力公司电力科学研究院、国网湖北省电力公司电力科学研究院、国网湖北省电力公司电力科学研究院、国网湖北省电力公司电力科学研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
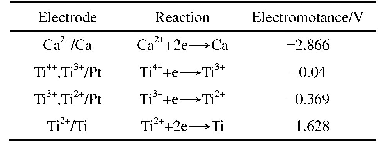
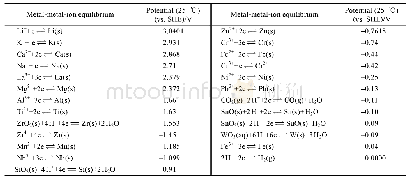
![表1 光催化转化CO2反应方程式及相应电极电位表[6]](http://bookimg.mtoou.info/tubiao/gif/ZRZZ202101012_00700.gif)