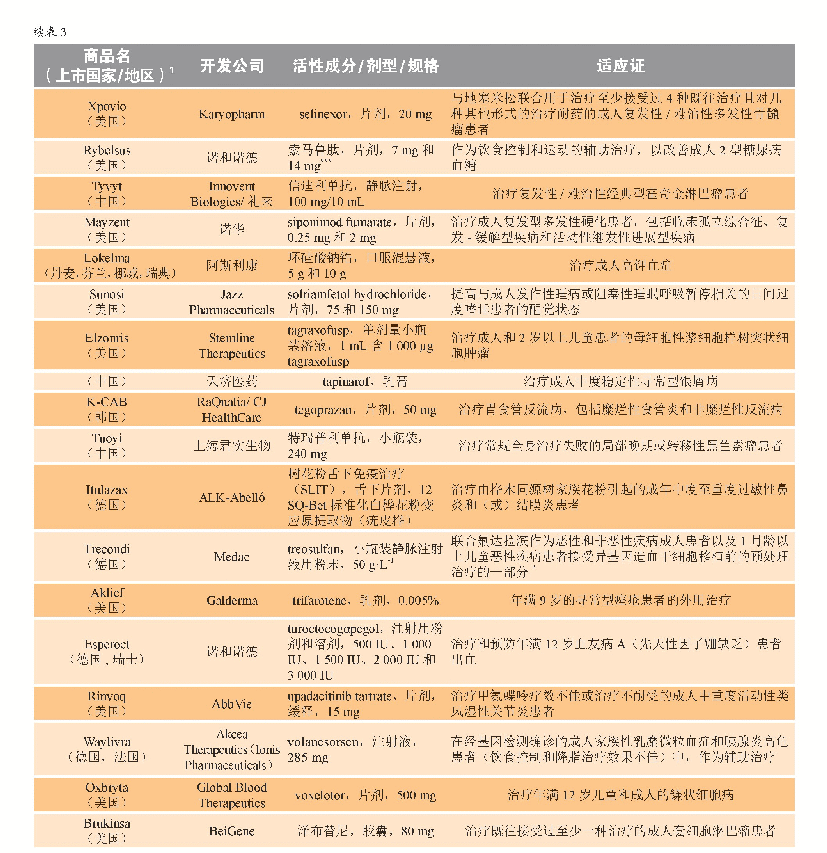
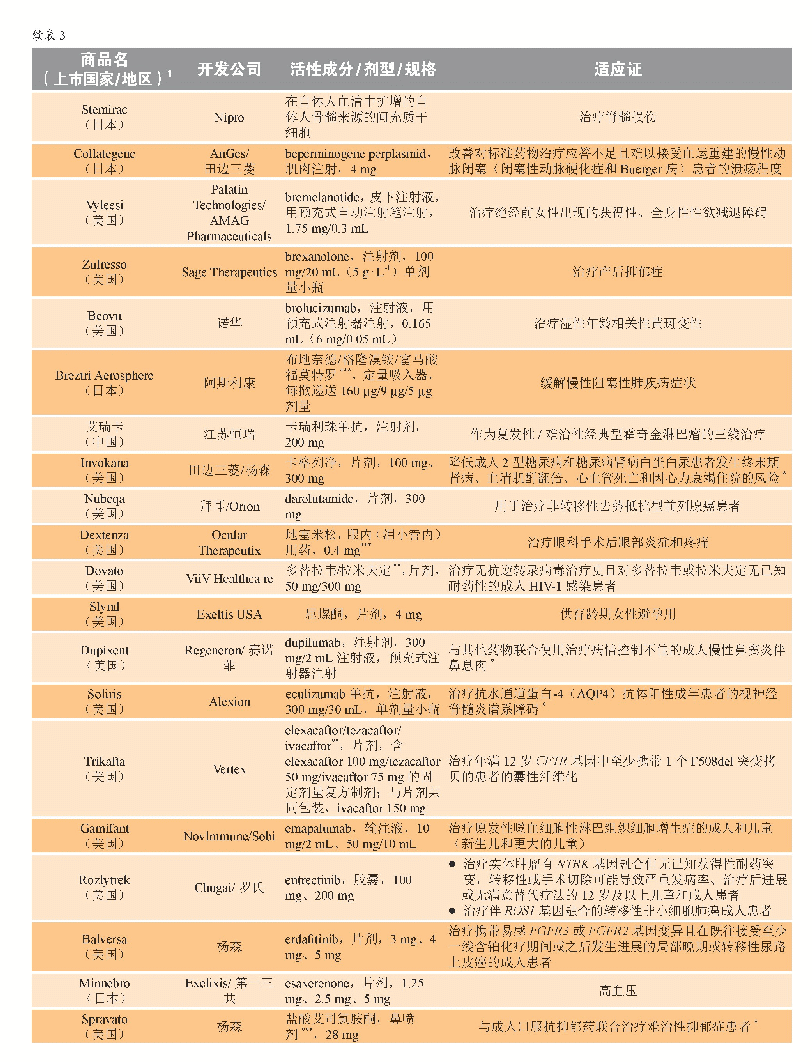
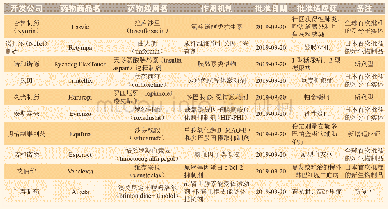
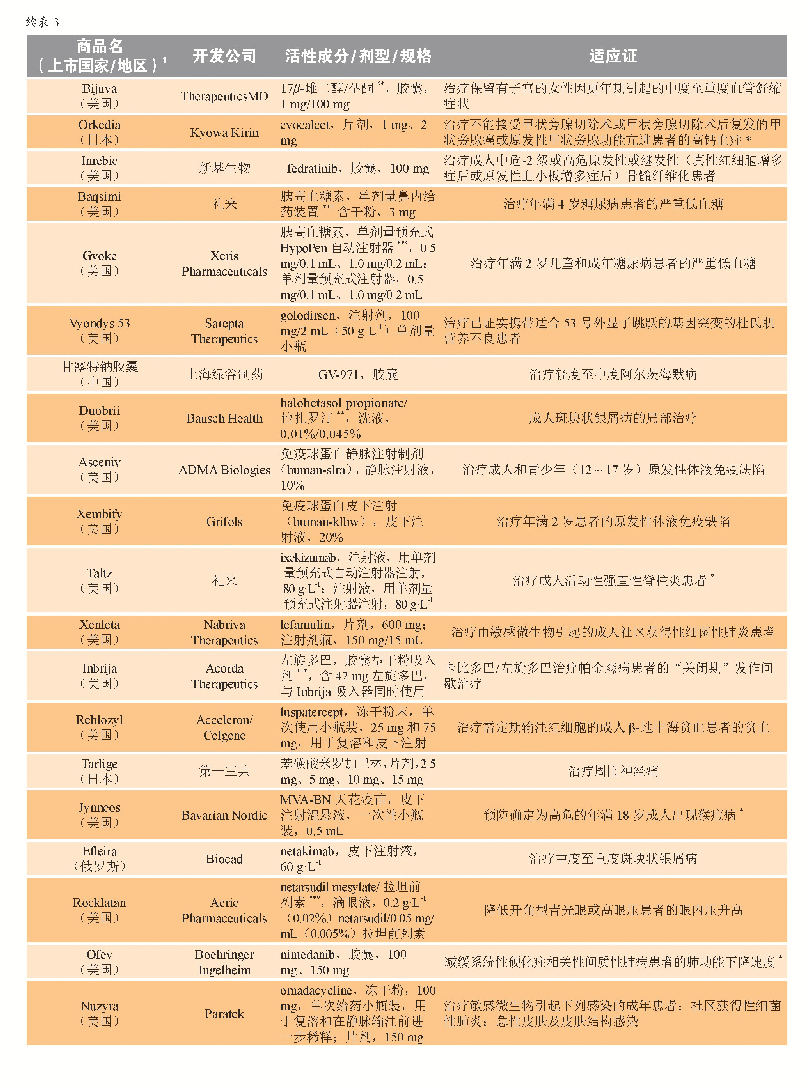
《表3 2019年新批准药物》
1国家代码为世界知识产权组织使用的缩写*:新适应证;**:新联合用药;***:新剂型
2019年5月,Ionis Pharmaceuticals及其全资子公司Akcea Therapeutics获得了volanesorsen(Waylivra)在欧盟有条件的上市许可,该药适用于作为基因检测确认家族性乳糜微粒血症(FCS)且胰腺炎风险较高的成人患者的饮食辅助治疗,这些患者对饮食限制和降脂治疗的应答不足。FCS是一种罕见的常染色体隐性遗传病,由脂蛋白脂肪酶突变引起,进而导致血浆中乳糜微粒蓄积和高三酰甘油血症[34]。在高三酰甘油血症的并发症中,急性胰腺炎是最为严重的一种。Volanesorsen是一种反义寡核苷酸,旨在减少载脂蛋白C-III(Apo C-III)的生成,而Apo C-III是一种调节血浆三酰甘油的蛋白。作为有条件上市许可的一部分,Akcea和Ionis公司基于临床试验登记将进行一项非干预性的许可后安全性研究(PASS)。Ⅲ期临床APPROACH研究(NCT02211209)是迄今为止针对FCS患者进行的最大规模的研究;在该研究中,与安慰剂相比,反义药物治疗导致具有临床意义和统计学意义的血浆三酰甘油水平降低。对有复发性胰腺炎病史的患者的分析显示,与安慰剂治疗组患者相比,接受volanesorsen治疗的患者中胰腺炎发作率显著降低。APPROACH试验中最常见的不良事件是注射部位反应和血小板水平降低。由于FCS是一种尚无有效治疗方案的罕见病,volanesorsen的研发获得了多个监管项目的支持,包括欧盟和美国的孤儿药资格认定以及英国突破性创新药物(PIM)资格认定。该产品于2019年8月在德国和法国上市。2019年上市新药完整清单详见表3。
| 图表编号 | XD00215032100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.25 |
| 作者 | Graul AI、Pina P、Tracy M、Sorbera L |
| 绘制单位 | 科睿唯安 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式