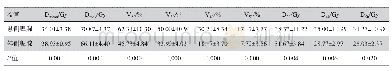
《表1 受试者受照射剂量危险度分类和相应的风险和获益》
*:保持在确定性效应阈值以下,治疗性研究除外
本机构伦理委员会在审查时通常会参考以下标准来进行审查。(1)依据国际放射防护委员会(ICRP)1990年推荐的放射性职业人员剂量限值:每人可接受的有效总放射剂量为5年100 mSv,平均每年20 mSv,且任何一年均不能超过50 mSv。(2)美国食品和药物管理局(FDA)对用于标记、体内药动学研究目的的放射性药物所致的全身和主要器官的有效辐射剂量有明确数值规定(美国联邦方案,21-361.1)[4],通常认为在药物药理学剂量及放射剂量规定的范围内开展放射性标记药物临床试验是安全的,具体标准:(1)对于年满18周岁的成年受试者,参加单个研究或1年以内参加多项研究,其累积的放射剂量如果超过以下剂量,则会被认为是不安全的,a.对于全身、活跃的造血器官、眼睛和性腺,单次剂量为30 mSv,多次剂量和年剂量总和为50 mSv;b.对于其他器官,单次剂量为50 mSv,多次剂量和年剂量总和为150 mSv。(2)对于18周岁以下的受试者,放射剂量不能超过上述规定的成人剂量的10%。需要说明的是,在计算总放射剂量和剂量限值时,应将研究药物中包含的所有放射性物质、整个研究过程中需接受的X线等放射线照射产生的放射剂量,以及可能的后续随访研究的放射剂量全部计算在内。放射剂量值应根据辐射吸收剂量来进行计算。(3)参照WHO在1977年提出并经ICRP第62号出版物修订的根据研究中受试者受照射剂量进行危险度分类(表1)[5],有助于在伦理审查时对研究方案进行风险评估。
| 图表编号 | XD00212437300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.25 |
| 作者 | 徐溢涛、缪丽燕、朱雪松、张华 |
| 绘制单位 | 苏州大学附属第一医院、苏州大学附属第一医院、苏州大学附属第一医院、苏州大学附属第一医院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式



![表1 干预前后受试对象危险行为的比较[n(%)]](http://bookimg.mtoou.info/tubiao/gif/XLYK202010026_01200.gif)
