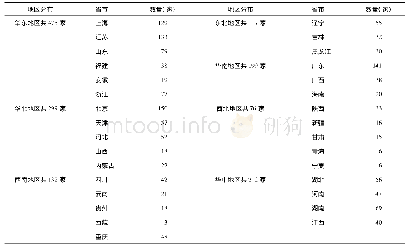
《表2 具有药物临床试验机构资格的医疗机构数量各地区分布情况》
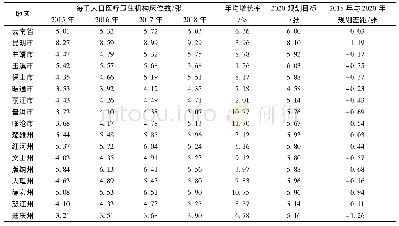
在临床试验机构实行备案制之前,我国有1万多家2级以上以及2 000多家3级和更高级别的医疗机构,但只有600多家能进行药物临床试验,其中只有100家能进行BE/I期试验。面对289目录中289个品种所涉及了17 740个文号需要进行一致性评价,可开展BE试验的机构的数量远远不够,临床资源短缺也成了当时一致性评价所面临的大问题[11]。2018年国家药品监督管理局发布了《关于调整药物临床试验审评审批程序的公告》(2018年第50号),该公告标志着临床试验机构备案制管理时代的到来,备案制允许合格的机构进行临床试验且并没有数量限制,这有助于解决临床试验机构短缺问题,加快临床试验进程,提高临床研究质量。据米内网数据显示,截至2020年8月,中国临床试验机构数据库拥有1 510条数据,具体分布见表2,可以看出我国具有临床试验资格的机构大部分集中在北京、上海、广东、江苏等地区,而中西部地区的机构数量相对少,各地临床试验机构数量差异明显。除了临床试验机构数量短缺之外,进行BE/I期临床试验的机构(主要集中在北京、上海、广东等地)执行与完成的试验项目数量不一致。同时因监管机构对试验数据的严格审查与试验风险的增大,导致可开展BE试验的医院接受BE/I期项目意愿并不强烈,相比BE试验,医院进行医疗服务效益更高,且不会因为出现风险而影响医院的声誉与其他临床试验开展[12]。
| 图表编号 | XD00199147000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.28 |
| 作者 | 胡宇、宗欣、于淼、李勇 |
| 绘制单位 | 中国药科大学国际医药商学院、国家药品监督管理局信息中心、国家药品监督管理局信息中心、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式