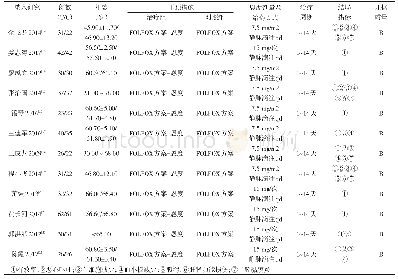
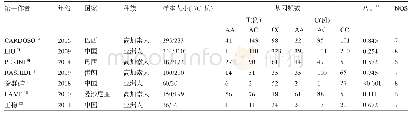
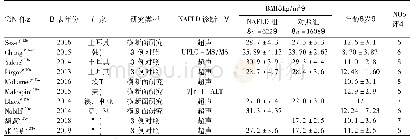
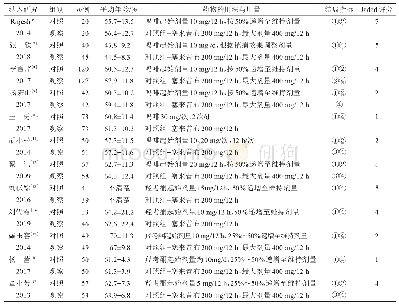
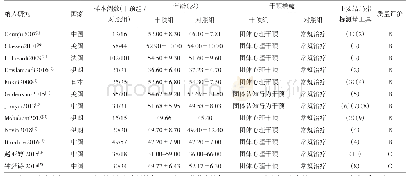
《表1 纳入研究的基本特征及质量评价》
注:P为前瞻性研究;R为回顾性研究。分类标准:1-年龄;2-剂量;3-频次;4-剂量/频次;5-用药途径;6-适应证;7-禁忌证;8-无儿童用药信息。质量评价:(1)确定的抽样框架是否能代替目标人群;(2)研究对象的抽样方法是否恰当;(3)样本量是否足够;(4)是否详细描述了研究对象及研究场所;(5)样
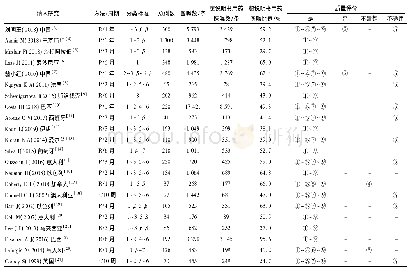
纳入文献发表时间为1999-2019年,涵盖17个国家,主要来自欧洲。欧洲起步最早(1999年)并持续关注;亚洲于2002年起步于以色列,发表时间集中于2016-2019年,主要来自中东地区;中国起步较晚(最早发表时间为2015年);美洲以巴西、加拿大为代表,共发表3个研究。纳入研究均有明确的药品纳入标准,除中国发表的2项研究[3,7]纳入所有药品外,其余研究排除的药品主要是水电解质平衡液、血液制品、肠外营养液等。所有研究均有超说明书用药医嘱的判断标准和分类。纳入研究采用的药品信息参考来源不一,7项研究[3,6-7,9,13-14,17]以药品说明书为依据,其余研究以药品管理部门批准发布的药品信息、行业协会编撰的药品信息集或指南手册、国家药典、临床用药信息数据库等为参考依据。纳入研究均为观察性研究,其中13项前瞻性研究,9项回顾性研究。14项研究[11-24]对象来自新生儿重症加护病房(NICU),其余8项[3-10]来自三级医院新生儿病房及NICU。共纳入3 400例次新生儿,47 226条用药医嘱,其中26 172条超说明书用药医嘱。纳入研究的基本特征及质量评价见表1。
| 图表编号 | XD00193324200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.02.10 |
| 作者 | 周怡廷、张钰、何华云、华子瑜 |
| 绘制单位 | 重庆医科大学附属儿童医院儿童发育疾病研究教育部重点实验室国家儿童健康与疾病临床医学研究中心儿童发育重大疾病国家国际科技合作基地儿科学重庆市重点实验室、重庆医科大学附属儿童医院儿童发育疾病研究教育部重点实验室国家儿童健康与疾病临床医学研究中心儿童发育重大疾病国家国际科技合作基地儿科学重庆市重点实验室、重庆医科大学附属儿童医院儿童发育疾病研究教育部重点实验室国家儿童健康与疾病临床医学研究中心儿童发育重大疾病国家国际科技合作基地儿科学重庆市重点实验室、重庆医科大学附属儿童医院儿童发育疾病研究教育部重点实验室国家 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式