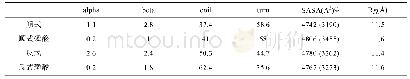
《表3 Thr231磷酸化对Tau226-236多肽六聚体的结构和形态的影响》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《Thr231磷酸化对顺式和反式tau蛋白226-236多肽六聚体结构的影响》
(1)SASA Total area and hydrophobic surface area of VAVV(parenthese)
一般来说β结构易于促进蛋白聚集,那么一个很自然的问题是Thr231磷酸化破坏Tau蛋白天然β折叠结构应该对应于Thr231磷酸化不易于引起tau的聚集从而减少其毒性。磷酸化tau蛋白毒性的一个显著特征是类似朊病毒一样的传播,这在顺式磷酸化tau蛋白中最为明显[30-32]。所以磷酸化tau蛋白毒性是由两部分组成:起始聚集的速度和类朊病毒样传播的速度。Tau蛋白起始聚集的速度更取决于微管作用域重复链段的聚集特性,特别是PHF6*:275VQIINK280和PHF6:306VQIVYK311。我们以上的结果表明顺式磷酸化tau蛋白226-235片段的β结构基本消失,顺式的也不高,所以tau蛋白226-235片段自身导致起始聚集速度的变化和可能性不高,除非VAVV疏水基团表面积变化能于PHF6*和PHF6的聚集高度关联。Tau蛋白类朊病毒样传播的速度取决于聚集成核区(比如PHF6*和PHF6)的表面暴露大小。我们推测顺式磷酸化tau蛋白226-235片段的链段伸展和疏水基团表面积可能使Tau蛋白的其他聚集成核区更容易暴露。当然这些需要对全长tau蛋白进行进一步的表征。
| 图表编号 | XD00182508600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.01 |
| 作者 | 孟青青、曾鑫成、苏玉红、白钢钢、Ruth Nussinov、马步勇 |
| 绘制单位 | 上海交通大学药学院细胞工程及抗体药物教育部工程研究中心、上海交通大学药学院细胞工程及抗体药物教育部工程研究中心、上海交通大学药学院细胞工程及抗体药物教育部工程研究中心、上海交通大学药学院细胞工程及抗体药物教育部工程研究中心、Basic Science Program, Leidos Biomedical Research, Inc., Frederick National Laboratory for Cancer Research, National Cancer Institute at Freder |
| 更多格式 | 高清、无水印(增值服务) |





