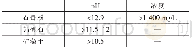
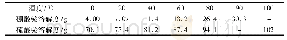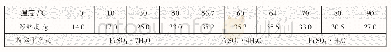《表1 硫酸亚铁、硫酸铵和摩尔盐的溶解度 (g/100 g H2O)》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《从“验证模式”到“辩证模式”的转变——进一步增强高校本科生实验创新能力》
通过课前预习,每位学生基本掌握实验原理,明确硫酸亚铁铵的制备及限量分析中实验过程。具体的实验原理如下:硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O],又称摩尔盐,为浅蓝绿色单斜晶体,它在空气中比一般的亚铁盐稳定,不易被氧化,常用来配制亚铁离子的标准溶液。硫酸亚铁铵可由等物质的量的Fe SO4和(NH4)2SO4反应制得,其反应如方程式(1)、(2)所示。硫酸亚铁,硫酸铵和摩尔盐在水中的溶解度列于表1。与其他复盐类似,硫酸亚铁铵在水中的溶解度比组成它的每一种组分Fe SO4或(NH4)2SO4的溶解度都要小。因此加热浓缩Fe SO4和(NH4)2SO4的混合溶液,冷却后即可得到摩尔盐晶体。在限量分析中,可以通过目视比色法半定量地确定产品中Fe3+离子的含量和产品的级数。目视比色法的基本原理如下:Fe3+遇到SCN-会形成红色的络合物,如方程式(3)所示。通过已知不同浓度的Fe3+溶液与SCN-在比色管中配制成标准色阶。相同条件下,将制备的(NH4)2Fe(SO4)2·6H2O产品与SCN-在比色管中配制成与标准色阶相同体积的溶液。和标准色阶进行对比,确定产品中Fe3+离子的大致含量和产品的级数。
| 图表编号 | XD0016398200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2018.03.28 |
| 作者 | 尹杰、代建荣、熊士现、乔艳玲、周华伟 |
| 绘制单位 | 聊城大学材料科学与工程学院、聊城大学化学化工学院、山东莘县第二中学、山东莘县第一中学、聊城大学材料科学与工程学院、聊城大学化学化工学院、聊城大学材料科学与工程学院、聊城大学化学化工学院 |
| 更多格式 | 高清、无水印(增值服务) |