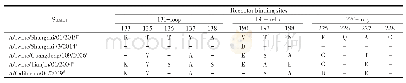
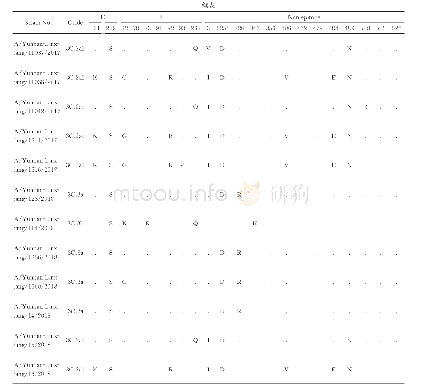
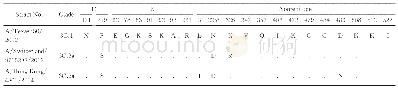
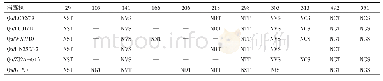
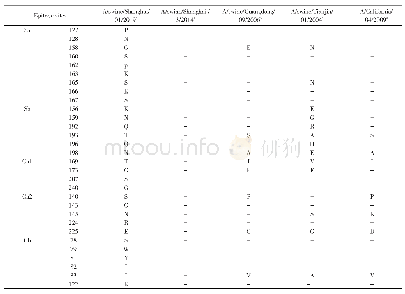
《表2 分离株HA蛋白抗原位点分析(H3 numbering)》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《一株猪流感病毒A/swine/Shanghai/01/2019(H1N1)的分离鉴定及遗传进化分析》
*:H1N1猪流感分离株;a:类禽型H1N1 SIV;b:经典型H1N1 SIV;c:类人型H1N1 SIV;d:2009 H1N1流感株;-:无突变
HA蛋白是流感病毒最主要的表面糖蛋白,是最主要的毒力和宿主范围决定因素,主要发挥病毒结合受体及膜融合的功能。在分离株A/swine/Shanghai/01/2019 HA蛋白的裂解位点(aa339~aa350)具有PSIQSR↓GLF-GAI序列,具备低致病性流感病毒的分子特征。流感病毒氨基酸的抗原位点、受体结合位点和潜在糖基化位点的突变都有可能改变流感病毒的抗原特性、宿主适应性和致病力。关键位点分析发现,该分离株HA蛋白有7个潜在的糖基化位点,分别27NNS、28NST、40NVT、212NHT、291NCT、498NGT、557NGS,其中HA1有5个,HA2有2个。该分离株HA蛋白的受体结合位点为(H3numbering)130-Loop(133R、135T、136T、137V、138A),190-Helix(190V,193T,198N),220-Loop(225E、226Q、227A、228G),与类禽型H1N1 A/swine/Shanghai/3/2014株相比,该分离株在190位发生突变,与其余参考株相比差异较大(表1)。参考Caton等确定的H1N1流感病毒HA蛋白Ca1、Ca2、Cb、Sa、Sb 5个抗原性位点区域[12],本研究分离株与A/swine/Shanghai/3/2014株抗原位点一致,但与经典型H1N1、2009 H1N1、类人型H1N1存在多个抗原位点氨基酸差异(表2)。
| 图表编号 | XD00159899100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.01 |
| 作者 | 程靖华、陶洁、李本强、石迎、刘惠莉 |
| 绘制单位 | 上海市农业科学院畜牧兽医研究所、上海市农业遗传育种重点实验室、上海市种猪工程技术中心、上海市农业科学院畜牧兽医研究所、上海市农业遗传育种重点实验室、上海市种猪工程技术中心、上海市农业科学院畜牧兽医研究所、上海市农业遗传育种重点实验室、上海市种猪工程技术中心、上海市农业科学院畜牧兽医研究所、上海市农业遗传育种重点实验室、上海市种猪工程技术中心、上海市农业科学院畜牧兽医研究所、上海市农业遗传育种重点实验室、上海市种猪工程技术中心 |
| 更多格式 | 高清、无水印(增值服务) |