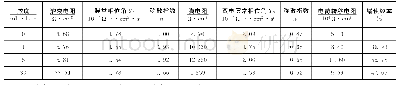
《表3 10%盐酸中不同浓度BCA条件下的交流阻抗拟合参数》
据图8的等效电路拟合所得的相关参数见表3。从表3可见:加入BCA后,电荷转移阻抗由空白酸液中的8.1Ω·cm2增大到4.00 mmol/L条件下的796.4Ω·cm2。可见BCA的加入增大了电极反应的阻抗,有利于大大降低腐蚀反应速率,这与失重法的结果是一致的;与未加BCA的体系相比,加入BCA后,吸附膜的双电层电容值Cd显著降低,这是由于BCA的介电常数比水分子要小得多,可以顶替水分子吸附于金属表面[16];当BCA的浓度达到1.00 mmol/L时,双电层电容Cd已由空白酸液中的1 888.4μF/cm2降至44.8μF/cm2。此时再继续增大BCA的浓度,Cd值变化较小,这表明当BCA为1.00 mmol/L时,BCA在钢片表面的吸附已接近饱和。当BCA浓度由0.25 mmol/L增大到2.00 mmol/L时,Weburg阻抗由10.8Ω·cm2增大到159.1Ω·cm2。可见随着BCA浓度的增大,Fe2+向酸液中的扩散所遇到的阻力在增大,这对缓蚀是有利的。特别是当BCA浓度达到2.00 mmol/L时,尽管此时BCA的吸附量已达到饱和,由于Weburg阻抗值从59.5Ω·cm2上升到159.1Ω·cm2,这意味着腐蚀反应的阻力将会因扩散阻抗的增加而继续增大,缓蚀效果会更好。失重法的结果也表明,当BCA的浓度由1.00mmol/L上升到2.00 mmol/L时,腐蚀速率仍会进一步下降。
| 图表编号 | XD00129695800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.15 |
| 作者 | 苏铁军、李克华 |
| 绘制单位 | 长江大学工程技术学院、长江大学化学与环境工程学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式